-
一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)c•dH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol• L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
高一化学计算题困难题查看答案及解析
-
一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)c•dH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol• L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
高一化学计算题困难题查看答案及解析
-
某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成, 设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
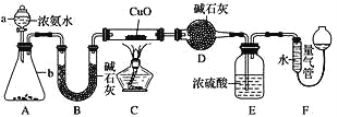
(1)仪器 a 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _________,表明 SO2 的氧化性比 I2___________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2,反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 ______________。
高一化学实验题中等难度题查看答案及解析
-
(6分)某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果:
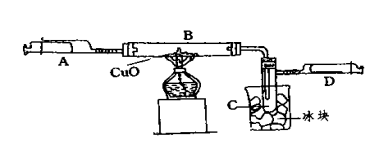
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是 mol;
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
高一化学填空题中等难度题查看答案及解析
-
某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
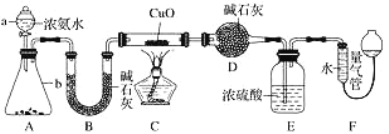
(1)仪器a的名称为_____;仪器b中可选择的试剂为________(填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式____________。
(4)E装置中浓硫酸的作用________。
(5)读取气体体积前,应对装置F进行的操作:__________。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n字母的代数式表示)。
高一化学实验题中等难度题查看答案及解析
-
某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
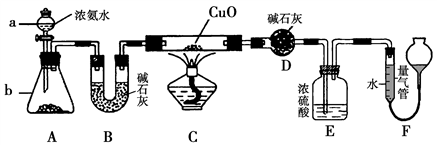
(1)仪器a的名称为____________。
(2)实验室中,利用装置A,还可制取的无色气体是____________(填字母)。
A.Cl2 B.O2
C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________性,写出相应的化学方程式___________________。
(4)E装置中浓硫酸的作用_________________。
(5)读取气体体积前,应对装置F进行的操作______________________________。
高一化学实验题困难题查看答案及解析
-
为研究 NH3的某种性质并测定其组成,某小组课外活动欲利用 CuO 与 NH3 反应,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
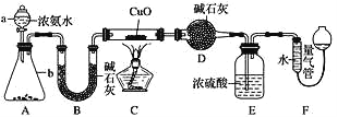
(1)仪器 D 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.铜与浓 H2SO4
C.碳与浓 H2SO4 D.Na2SO3 固体与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _______________________,表明 SO2 的氧化性比 I2________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
高一化学实验题简单题查看答案及解析
-
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
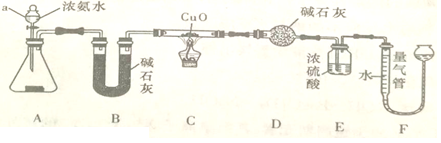
(1)仪器a的名称为______________。
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,最气管中有无色无味的气体产生。上述现象证明NH3 具有______性,写出相应的化学方程式:______________。
(3)E装置中浓硫酸的作用是______________。
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为VL(已折算成标准状况),则氨分子中氮、氢的原子个数比值为_____(用含m、V字母的代数式表示)。
高一化学实验题中等难度题查看答案及解析
-
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;
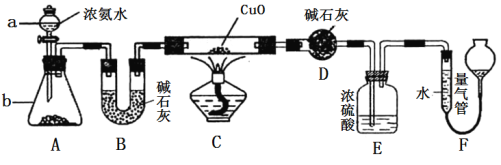
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式 。
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
高一化学实验题困难题查看答案及解析
-
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
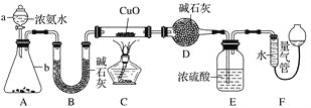
(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
高一化学实验题中等难度题查看答案及解析