-
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
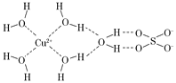
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
(5)As 的卤化物的熔点如下:
| AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
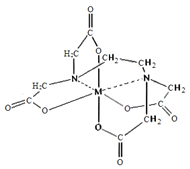
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。
-
物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
| AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
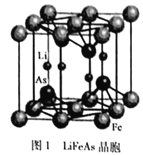
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。
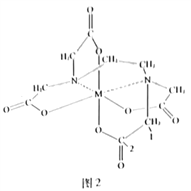
(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1) 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁 Ⅲ
Ⅲ ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___ 碳原子为____杂化,
碳原子为____杂化, 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中 键
键 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇 属于____晶体.
属于____晶体. 存在的化学键有_____
存在的化学键有_____ 填字母
填字母 .
.
A.离子键  极性键
极性键  非极性键
非极性键  配位键
配位键  氢键
氢键  金属键
金属键
(4)已知: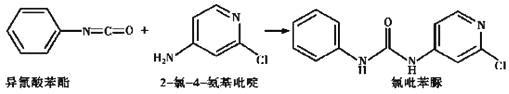 ,反应后,
,反应后, 键_____,
键_____, 键_____
键_____ 填“增加”或“减少”
填“增加”或“减少” .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则
 咪唑
咪唑 中的“离域
中的“离域 键”可表示为_________
键”可表示为_________
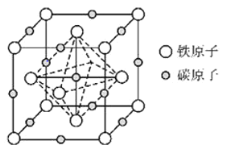
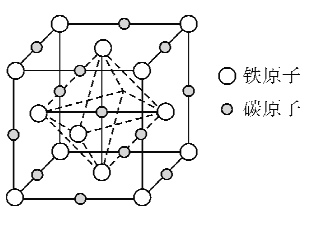
(6)奥氏体是碳溶解在 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为 ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______ 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 .
.
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1) 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁 Ⅲ
Ⅲ ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___ 碳原子为____杂化,
碳原子为____杂化, 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中 键
键 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇 属于____晶体.
属于____晶体. 存在的化学键有_____
存在的化学键有_____ 填字母
填字母 .
.
A.离子键  极性键
极性键  非极性键
非极性键  配位键
配位键  氢键
氢键  金属键
金属键
(4)已知: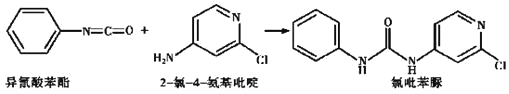 ,反应后,
,反应后, 键_____,
键_____, 键_____
键_____ 填“增加”或“减少”
填“增加”或“减少” .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则
 咪唑
咪唑 中的“离域
中的“离域 键”可表示为_________
键”可表示为_________
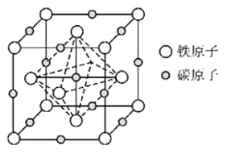
(6)奥氏体是碳溶解在 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为 ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______ 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 .
.
-
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(1)Ni在元素周期表中的位置是______.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子______.配体NH3中N原子的杂化类型为______,它可用作致冷剂的原因是______.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有______种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为______,NiO(OH)溶于浓盐酸的化学方程式为______.
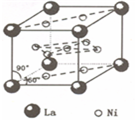
(4)镍和镧( )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=______.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=______.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y NiO(OH)  LaNix+y NiO+y H2O.写出其放电时负极的电极反应方程式______.
LaNix+y NiO+y H2O.写出其放电时负极的电极反应方程式______.
-
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
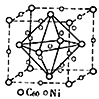
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
-
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
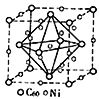
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
-
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X最高价氧化物的水化物与气态氢化物可以形成一种盐 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第__________周期第_________族;Z的原子半径比Y的________, X的第一电离能比Y的________(填“大”或“小”)。
(2)W基态原子的核外电子排布式为____ ____,XH3分子的沸点较高,请解释其原因____ 。
(3)X的氢化物(X2H4)的制备方法之一是将NaClO溶液和XH3反应制得,试写出该反应的离子方程式 。
(4)已知下列数据:4W(s)+ O2(g) = 2W2O(s) △H = -337.2 KJ/mol 2W(s)+ O2(g) = 2WO(s) △H = -314.6 KJ/mol;由W2O和O2反应生成WO的热化学方程式是 。
-
下列关于配合物的叙述中,不正确的是 ( )
A、配位化合物中必定存在配位键
B、配位化合物中只有配位键
C、配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用
D、[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:
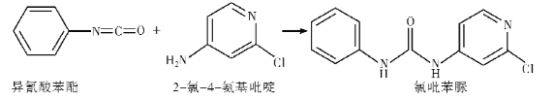
反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则 (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。




 ,反应后,
,反应后,
 ,反应后,
,反应后,




