-
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。

从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
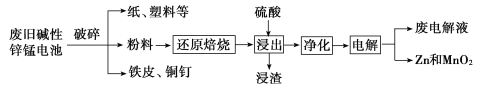
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O==Zn(OH)2+2MnO(OH),下列说法不正确的是
A. 电池工作时,锌为负极 B. 电池工作时,电解液中的OH- 移向负极
C. 电池正极发生还原反应 D. 锌的质量减少6.5g时,溶液中通过0.2mol电子
-
碱性锌锰电池的总反应为:Zn + 2MnO2 + 2H2O = Zn(OH)2+ 2MnO(OH),下列说法不正确的是( )
A. 该电池Zn为负极,MnO2为正极,电解质是KOH
B. 放电时外电路电流由Zn流向MnO2
C. 电池工作时OH-向锌电极移动
D. 该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH—
-
碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
-
碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.锌锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+2H2O+2e-==2MnOOH+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
-
请仔细观察两种电池的构造示意图,
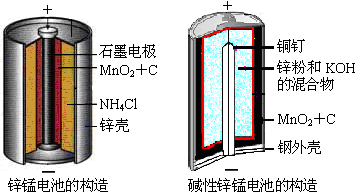
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,
则负极的电极反应式: 。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其可能的原因是 。
(3)原电池可将化学能转化为电能。某课外活动小组设计两种类型的原电池,以 探究其能量转化效率。
限选材料:ZnSO4(aq), CuSO4(aq);铜片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注。

(要求:在同一烧杯中,电极与溶液含相同的金属元素)
②组装原电池乙,要求:以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,(填“甲”或“乙”),其原因是 。
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是
A. 电池工作时,锌失去电子
B. 电池正极电极反应式2MnO2(s)+2H2O(l)+2e-=2MnOOH(s)+2OH-(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
-
碱性锌锰干电池的总反应方程式可以表示为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH 此电池放电时,正极上发生反应的物质是( )
A. 碳棒 B. MnO2和H2O C. Zn D. MnO2
-
碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O = 2MnOOH + Zn(OH)2,电解质是KOH。下列说法正确的是
A、碱性锌锰电池是二次电池
B、MnO2发生了还原反应
C、反应消耗 0.65gZn,有0.01 mol电子发生转移
D、电池正极的反应为:Zn + 2 OH-–2e-=Zn(OH)2


