-
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
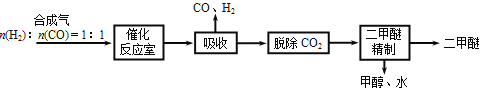
I.Ⅰ.工业制备二甲醚的生产流程如下:
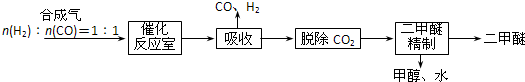
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
CO(g)+2H2(g) CH3OH(g)△H=-90.7kJ/mol ①
CH3OH(g)△H=-90.7kJ/mol ①
2CH3OH(g) CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol ②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol ②
CO(g)+H2O(g) CO2(g)+H2(g)△H=-41.2kJ/mol ③
CO2(g)+H2(g)△H=-41.2kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2
O2 CO(g)+2H2(g) △H=-35.6kJ/mol。该反应是_______反应(填“自发”或“非自发”)
CO(g)+2H2(g) △H=-35.6kJ/mol。该反应是_______反应(填“自发”或“非自发”)
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H=______,830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有________。
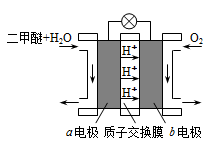
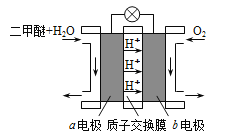
II.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b 电极是______极。
-
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:
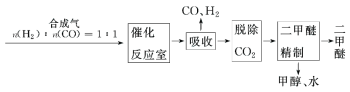
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OH(g) ΔH=-90.7 kJ/mol ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有__________。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。
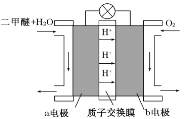
a电极是________极,其电极反应方程式为_________________。
-
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有_______。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是_______极。
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
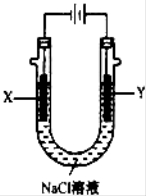
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小 ”或“不变”,下同)。
”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式  ;
;
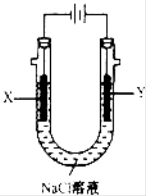
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。
(1) 写出甲醚燃烧的热化学方程式___________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热为___________
(2) 工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是___________(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”)
(3) 以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式的其中一个产物是CO32-,请写出该反应的负极反应式___ _ ;
-
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚 燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3 的产率将 (填“变
的产率将 (填“变 大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)写出二甲醚燃烧热的热化学方程式_______________________________________________;当燃烧放出582kJ热量时,转移的电子数为_______________。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为______________________________;
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______________________________(选填字母编号)
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将_______________(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_______________。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)当燃烧放热582kJ热量时,转移的电子数为___。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mol;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为__;
(3)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)⇌CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是__(选填字母编号)
A.c(H2)与c(H2O)的比值保持不变
B.单位时间内有2molH2消耗时有1molH2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将__(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将__。
-
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。
请填写下列空白:
(l)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:_____________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:______________________________。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:_________________________。

CH3OH(g) ΔH=-90.7 kJ/mol ①
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol ②
CO2(g)+H2(g) ΔH=-41.2 kJ/mol ③
O2(g)
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是____________反应(填“自发”或“非自发”)。
CH3OCH3(g)+CO2(g)的ΔH= _____________。该反应的平衡常数表达式为:_______;在830℃时K=1.0,则在催化反应室中该反应的K______1.0(填“>”、“<”或“=”)。






