-
常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7
Ka2=5.6×10-11
Ka=1.7×10-5
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。
高二化学综合题中等难度题查看答案及解析
-
常温下.有浓度均为0.1 mol·L-l的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
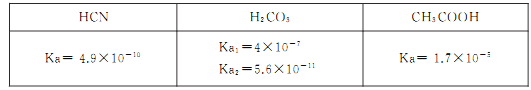
(1)这4种溶液pH由大到小的顺序是____(填序号),其中②由水电离的H+浓度为____。
(2)①中各离子浓度由大到小的顺序是 ___。
(3)④的水解平衡常数Kh=___mol/L。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③___ ④(填“>”、“<"、“=”)
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为____。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:____。
约为____。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:____。高二化学填空题困难题查看答案及解析
-
常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7
Ka2=5.6×10-11
Ka=1.7×10-5
(1)这4种溶液pH由大到小的顺序是____________(填序号)。
(2)④的水解平衡常数Kh= _________。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:______________________。
高二化学填空题中等难度题查看答案及解析
-
完成下列各题.
(1)常温下,浓度均为 0.1mol•L﹣1 的下列五种钠盐溶液的 pH 如表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合H+能力最强的是 ,根据表中数据,浓度均为0.01mol•L﹣1 的下列四种酸的溶液分别稀释 100倍,pH变化最大的是 (填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的OH-个数:① ②(填“>”、“=”或“<”,下同).
溶液中阴离子的物质的量浓度之和:① ②.
(3)NaCN遇水可产生易燃的HCN气体,浓度均为0.1mol/L的NaCN和HCN的混合液中滴加酚酞,溶液变红,则混合液中各离子的浓度大小关系为_______________________。
(4)研究证实,CO2可在酸性水溶液中通过电解生成甲醇(CH3OH),则生成甲醇的反应发生在 (填阴极或阳极),该电极反应式是 。
(5)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在含Cu2+,Ni2+的溶液中,当Ni2+恰好完全沉淀[此时溶液中c(Ni2+)=1.0×10-5 mol·L-1],溶液中Cu2+的浓度是_____________mol·L-1。
高二化学填空题简单题查看答案及解析
-
完成下列各题.
(1)常温下,浓度均为 0.1mol•L﹣1 的下列五种钠盐溶液的 pH如表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合H+能力最强的是___________,根据表中数据,浓度均为0.01mol•L﹣1 的下列四种酸的溶液分别稀释 100倍,pH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的OH-个数:①_________②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:①__________②。
(3)NaCN遇水可产生易燃的HCN气体,浓度均为0.1mol/L的NaCN和HCN的混合液中滴加酚酞,溶液变红,则混合液中各离子的浓度大小关系为_______________________。
(4)研究证实,CO2可在酸性水溶液中通过电解生成甲醇(CH3OH),则生成甲醇的反应发生在_______ (填阴极或阳极),该电极反应式是_________________。
(5)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在含Cu2+,Ni2+的溶液中,当Ni2+恰好完全沉淀[此时溶液中c(Ni2+)=1.0×10-5 mol·L-1],溶液中Cu2+的浓度是_____________mol·L-1。
高二化学填空题简单题查看答案及解析
-
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1 mol/L的下列五种钠盐溶液的pH如表所示:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述几种钠盐的阴离子,结合氢离子能力最强的是______(填离子符号),根据表中数据,将浓度均为0.01mol/L的下列四种溶液分别稀释100倍,pH变化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知几种离子开始沉淀时溶液的pH如下表所示:
离子
Fe2+
Cu2+
Mg2+
pH
7.6
5.2
10.4
当向含有相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一),则应向溶液中加入氢氧化钠溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}
高二化学综合题中等难度题查看答案及解析
-
(10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________________________。
②几种离子开始沉淀时的pH如下表:
离子
Fe2+
Cu2+
Mg2+
pH
7.6
5.2
10.4
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,
_________
(填“>”、“=”或“<”)。
高二化学填空题简单题查看答案及解析
-
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
离子
Fe2+
Cu2+
Mg2+
pH
7.6
5.2
10.4
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
高二化学填空题中等难度题查看答案及解析
-
依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
①上述盐溶液中的阴离子结合H+能力最强的是________。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
(2)依据表中数据计算CH3COOH的电离常数Ka=________(已知100.4=2.5,用科学计数法表示)
高二化学综合题中等难度题查看答案及解析
-
(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为 (填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
高二化学填空题中等难度题查看答案及解析