-
工业上用氢气合成氨气的原理为:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)用太阳能分解水制备H2是一项新技术,其过程如下
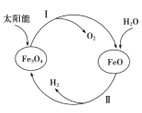
已知:2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ·mol-1 2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.8kJ·mol-1
①过程Ⅱ的热化学方程式是____________________________________.
②整个过程中,Fe3O4 的作用是________________________.
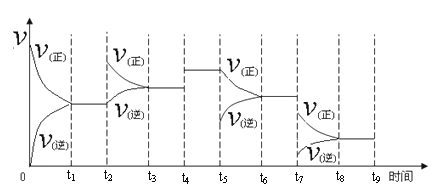
(2)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示.
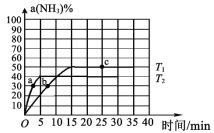
①下列有关说法正确的是_______________________
A 由b点到c点混合气体密度逐渐增大
B 达到平衡时,2v正(H2)=3v逆(NH3)
C 平衡时,通入氩气平衡正向移动
D 平衡常数,ka<kb=kc
②T1 温度时,0-15min内v(H2)=___________ mol·L-1·min-1.
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k 为速率常数,只与温度有关).温度由T1 调到T2,活化分子百分率 ______________(填“增大”“减小”或“不变”),k正增大倍数______________k逆增大倍数(填“大于”“小于”或“等于”).T1℃时,k正/k逆=__________ 。
-
(15分)工业上用N2和H2 合成NH3 “N2(g) + 3H2(g) 2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) =2NO(g) ∆H1= +a kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ∆H2=-b kJ·mol-1
2NH3(g) ∆H2=-b kJ·mol-1
2H2(g) + O2(g) =2H2O(g) ∆H3=-c kJ·mol-1
若有34 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)合成NH3达到平衡后,某时刻改变下列条件 ,在达到新平衡的过程中正反应速率始终增大。
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
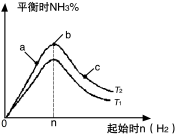
①图像中T2和T1的关系是:T2 T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最大的是 (填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度
为 mol·L-1。
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
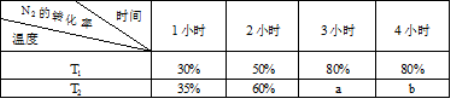
上表中a、b、80%三者的大小关系为 (填“>”、“=”、“<”、“无法比较”)。
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在下图中画出平衡常数K随时间的变化曲线。

-
工业上合成氨的反应如下:N2(g) + 3H2(g) 2NH3(g),以下措施中,既能加快反应速率,又能增大氢气转化率的是
2NH3(g),以下措施中,既能加快反应速率,又能增大氢气转化率的是
A. 升高温度 B. 增大容器体积 C. 移走氨气 D. 增加氮气
-
工业上合成氨的反应如下:N2(g) + 3H2(g) 2NH3(g)+Q,以下措施中,既能加快反应速率,又能增大氢气转化率的是
2NH3(g)+Q,以下措施中,既能加快反应速率,又能增大氢气转化率的是
A. 升高温度 B. 增大容器体积 C. 移走氨气 D. 增加氮气
-
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 ________t5 ________ t7________。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是________。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2 2NH3 +92.4KJ
2NH3 +92.4KJ
(1)它是氮的固定的一种,属于_____________( 选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_________________________________________mol/(L∙S)。
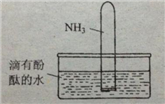
(4)如右图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是_______________________________。
___________________________________________________.
-
氮气与氢气反应生成氨气的平衡常数见下表:
| N2+3H2  2NH3 2NH3 |
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(1)工业上合成氨的温度一般控制在500℃,原因是________。
(2)在2 L密闭容器中加入1 mol氮气和3 mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为________mol/(L·min)。
(3)下列说法能表明该反应达到平衡的是________
A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化
C.v (N2) = 2 v (NH3) D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是______________
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl-)比值变大的是________
A. 加入固体氯化铵 B.通入少量氯化氢
C. 降低溶液温度 D.加入少量固体氢氧化钠
-
I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g) 和H2(g),发生反应:N2(g)+3H2(g)⇌2NH3(g) △H=—Q kJ/mol(Q>0),NH3物质的量随时间的变化如图所示。
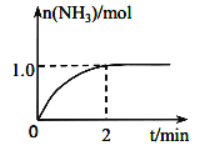
(1)0到2 min 内的平均反应速率 v(H2)=________。
(2)该温度下,反应 N2(g)+3H2(g) 2NH3(g) △H = —Q kJ/mol(Q>0)的平衡常数表达式K=________________。其平衡常数K与温度T的关系如下表:
2NH3(g) △H = —Q kJ/mol(Q>0)的平衡常数表达式K=________________。其平衡常数K与温度T的关系如下表:
| T/ ℃ | 25 | 125 | 225 |
| 平衡常数 K | 4×106 | K1 | K2 |
试判断K1_______K2(填写“>”“=”或“<”)。
(3)若反应是在固定体积的密闭容器中进行,下列能说明合成氨反应已达到平衡状态的是___(填字母)
A.3v(N2) = v(H2)
B.容器内压强保持不变
C.混合气体的密度保持不变
D.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
-
I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g) 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
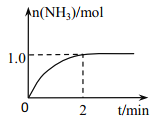
(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g) 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
| T/ ℃ | 25 | 125 | 225 |
| 平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
| 实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
| ① | 0. 2 | 0.2 | pH=x |
| ② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 测量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】试题分析:I.(1)根据 计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)
计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g) 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
解析:I.(1)2min内生成1mol氨气,则消耗氢气1.5mol,  =
= 0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=
0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K= ;反应 N2(g)+3H2(g)
;反应 N2(g)+3H2(g) 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g) 2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据
2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据 ,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,  ,Q=K,反应一定达到平衡状态,故d正确。
,Q=K,反应一定达到平衡状态,故d正确。
II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解 ,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
点睛:同浓度、同体积的一元强酸与一元弱碱混合,溶液呈酸性;同浓度、同体积的一元弱酸与一元强碱混合,溶液呈碱性;同浓度、同体积的一元强酸与一元强碱混合,溶液呈中性。
【题型】综合题
【结束】
23
为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
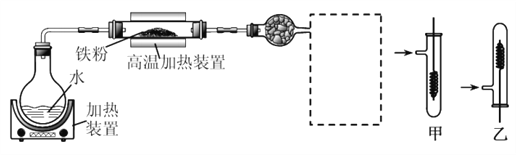
已知:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是______________________。
(2)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_______溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由_________________。
实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。
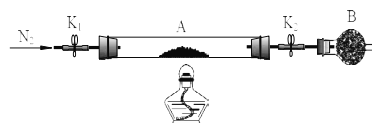
实验步骤如下:(1)________,(2)点燃酒精灯,加热,(3)______,(4)______,(5)______,
(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
(3)请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2 b.熄灭酒精灯 c.打开 K1 和 K2 缓缓通入 N2 d.冷却至室温
(4)必须要进行恒重操作的原因是_________________。
(5)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,
计算绿矾化学式中结晶水数目 x=__________________(用含 m1、 m2、 m3的列式表示)。
-
液氨是一种良好的储氢物质。
已知:① 2NH3(g)  N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
② 液氨中2NH3(l)  NH2- + NH4+
NH2- + NH4+
(1)氨气自发分解的反应条件是 (填“低温”或“高温”)。
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。反应的活化能最大 的是 (填催化剂的化学式)。
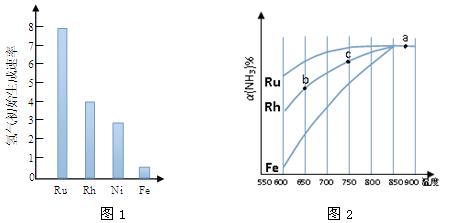
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点氨气的转化率高于b点,原因是 。
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线。
④假设Ru催化下,温度为750℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的 平衡常数K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
2NH3(g) ΔH<0










