-
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式________;
(2)B、C、D三种元素电负性由大到小的顺序是________(用元素符号表示);
(3)下列有关上述元素的说法,正确的是________(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为________,1 mol B2A4分子中含有________molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是。
说明:O摄氏度=273K
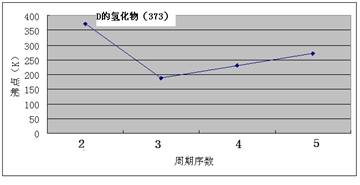
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
-
A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
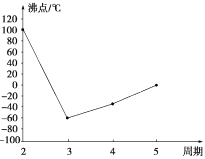
(1)写出F元素基态原子的核外电子排布式:____________。
(2)B、C、D三种元素电负性由大到小的顺序是____________(用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________(填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________,1 mol B2A4分子中含有________个σ键;
-
A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是内层电子数的3倍;D与G处在同一族;F是地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于 (填晶体类型)。
(4)CA3分子的电子式为 。
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取 杂化;1 mol乙分子含有 molσ键。
-
A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是内层电子数的3倍;D与G处在同一族;F是
地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于 (填晶体类型)。
(4)CA3分子的电子式为 。
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取 杂化;1 mol乙分子含有 molσ键。
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
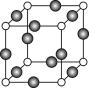
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。
-
【化学——选修3物质结构与性质】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由小到大的顺序为________(填元素符号)。
(3)E(BD)4为无色或黄色挥发性剧毒液体,熔点-19.3℃,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,E与BD之间的作用力为 。
(4)①写出一种与BD32-互为等电子体的分子的化学式 。
②含F2+的溶液与K2SO4、氨水反应可得到化合物 [F(NH3)4]SO4。1 mol配合物离子[F(NH3)4]2+中含σ键的数目为 。
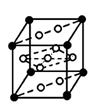
③ E元素与镧(La)元素的合金可做储氢材料,该晶体的晶胞如图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为 ;已知该合金的摩尔质量为M g•mol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
-
已知X、Y、Z、W、R五种元素均位于周期表的前四周期,且原子序数依次增大。元素X的基态原子中电子占据了三种能量不同的原子轨道,且成对电子数是未成对电子数的2倍;元素Y与W同主族,且Y是地壳中含量最多的元素;Z基态原子有12种不同运动状态的电子;元素R基态原子最外层只有1个电子且内层电子全充满。
请回答下列问题:(答题时,X、Y、Z、W、R用所对应的元素符号表示)
(1)基态Y原子的轨道式表示式为 ___。
___。
(2)元素Y、W均可形成含18个电子的氢化物,其中Y的氢化物沸点较高,原因是___;
(3)元素Z与同周期相邻两元素第一电离能由高到低的顺序为___。
(4)元素R在周期表中位于___区,R分别与Y、W形成离子化合物R2Y和R2W,其中熔点较高的为___。
(5)R2+与过量的氨水形成的配离子的化学式为[R(NH3)4]2+,在配离子中与R2+形成配位键的原子是___。
(6)X的一种单质(相邻原子间通过共价键形成空间网状结构)、XY2、WY2、ZW对应的晶体熔沸点由高到低的顺序为___。
-
已知A、B、C、D、E、W是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。W是第四周期d区原子序数最大的元素。请回答下列问题:
(1)填元素名称, C:________写出E的价层电子排布式_________,W在周期表中的位置:___________________
第二周期基态原子未成对电子数与W相同且电负性最小的元素是________(填元素符号).
(2)W(BD)n为无色挥发性剧毒液体,熔点﹣25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,W(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,BD分子的结构式是________
(3)3﹣氯﹣2﹣丁氨酸的结构简式为: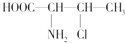 ,一个该有机物分子中含有_____个手性碳原子.
,一个该有机物分子中含有_____个手性碳原子.
-
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体;A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
(1)E的基态原子的价电子排布图为______。
(2)B、C、D三种元素的氢化物的沸点高低顺序为__________(用化学式表示,下同),稳定性顺序为__________。
(3)化合物M是同类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为____,B原子的杂化类型为____,M能和水以任意比混溶的原因是______________。
(4)E的一种氧化物Q,其晶胞结构如图1所示,则Q的化学式为____。

(5)电镀厂排放的废水中常含有剧毒的BC-,可在Q的催化下,先用NaClO将BC-氧化成BCD-,然后在酸性条件下BCD-可以继续被NaClO氧化成C2和BD2。
①与BCD-互为等电子体的分子是____(写出一种即可);可以推知BCD-的空间构型为__。
②上述反应中后一步反应的离子方程式为_____________。
(6)E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图2所示,则E晶胞中E的配位数为____,若该晶胞的密度为a g·cm-3,阿伏加德罗常数为NA,E原子的摩尔质量为M g·mol-1,则E原子的半径为____cm。
-
A、B、C、D、E为短周期元素且它们的原子序数依次增大,A的核外电子总数与其周期数相同,其中D原子的L电子层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L电子层中未成对电子数与D相同,但还有空轨道;D与E同族,请回答下列问题:
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为______,其中心原子的杂化方式为______,A分别与B、C、D形成的共价化合物中既含有极性共价键,又含有非极性键的化合物是________________________。(填化学式,任意写出三种)。
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是______________________(填化学式,下同);酸根离子呈三角锥形结构的是____________。
(3)BA4分子的立体构型为__________;根据电子云重叠方式的不同,该分子里共价键的类型为_________。
(4)B的一种氢化物相对分子质量是26,其分子中σ键和π键的键数之比为_________。
(5)B与D形成BD2分子,与该分子互为等电子体的有____________________。(分子跟阴离子各写一个)




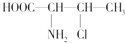 ,一个该有机物分子中含有_____个手性碳原子.
,一个该有机物分子中含有_____个手性碳原子.