-
雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2 CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)  2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。

①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____mol•L﹣1。(NH3•H2O 的电离平衡常数K =2×10﹣5 mol•L﹣1)
-
近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g) 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g) 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2 CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
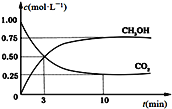
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
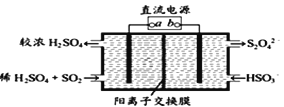
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
-
近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、氮氧化物等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1) 用CaSO4代替O2与燃料CO反应,是一种高效、清洁、经济的新型燃烧技术,既可提高燃烧效率,又能得到较纯的CO2,以便于被处理。反应①为主反应,反应②和③为副反应。
ⅰ.CaSO4(s)+4CO(g)==CaS(s)+4CO2(g) ΔH1=-189.2 kJ·mol-1
ⅱ.CaSO4(s)+CO(g)==CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
ⅲ.CO(g)== C(s)+
C(s)+ CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)==CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=_________________
(2)已知由CO生成CO2的化学方程式为CO+O2 CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。在2500 K下,K正=1.21×105 L·s-1·mol-1,K逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为________(保留小数点后一位小数)。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=___________________________________;
②30 min后只改变某一条件,反应达新平衡,根据上表数据判断改变的条件可能是____(选填字母);
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则Q_____0 (填“>”、“=”或“<”)。
(4)利用如图所示电解装置(电极均为惰性电极)也可吸收SO2,并用阴极室排出的溶液吸收NO2。与电源b极连接的电极的电极反应式为____________________________________。

(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
-
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
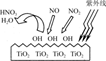
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是________。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是________。
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- ________SO32-+____N2+____
________SO32-+____N2+____
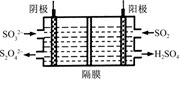
(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为________。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为________。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条):______ 。
-
今年我国多个城市遭雾霾天气,这表明污染严重,空气质量下降。因此研究NO2、SO2、CO等大气污染气体的处理具有重要现实意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。
(2)利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(3)硝酸工业尾气中含NO和NO2气体,常用NaOH溶液来吸收,反应方程式为NO+NO2+2NaOH====2NaNO2+H2O,该反应中氧化剂和还原剂的物质的量之比是 。
(4)SO2是形成酸雨的主要物质,可以用氨水吸收消除污染,写出过量氨水与SO2反应的离子方程式 。
-
下列说法不正确的是
A.可以用Si3N4、Al2O3制作高温结构陶瓷制品
B.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶
C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
D.据测定,许多反应的温度每升高10K,其反应速率增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率
-
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
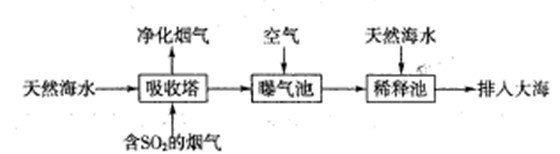
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
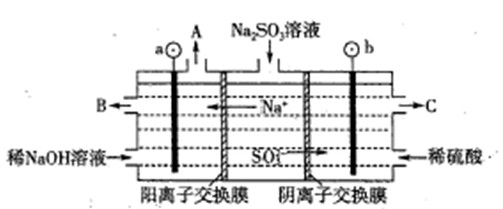
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
-
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
A.水体富营养化 B.重金属污染 C.雾霾 D.酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:A的化学式为 ,若生成ag A,理论上可以回收SO2的质量为 g。
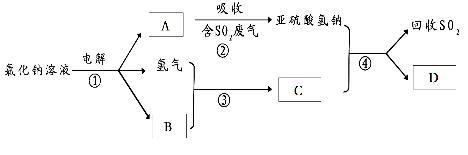
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
-
火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有________________________________________________________________________________________________________________________________ (填写字母编号)
A水体富营养化 B重金属污染 C雾霾 D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式________________________________________________________________________________________________ ________________________________________。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式________________________ ________________________,若生成ag A,理论上可以回收SO2的质量为________________________________________________ g。
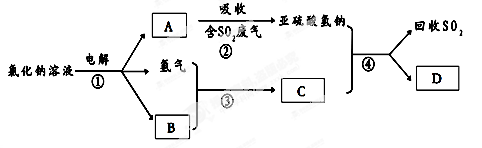
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式________________________________________________________________________________________________________________________ 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式________________________________________________________________________________________________ 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式________________________________________________________________________________________ 。
-
进入秋季,浙江省中部盆地区域雾霾天气时有发生,PM2.5污染较为严重,PM2.5约50%来源于某些气体污染物在空气中转变而成的二次颗粒物。氮氧化物、SO2是主要污染物。因此氮氧化物、SO2的处理成为化学家的重要课题。
(1)如图1所示的电解装置( 电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO
电极均为惰性电极)可吸收SO2,并用阴极排出的溶液在碱性条件下吸收NO2,转化为无污染的N2和SO ,请写出阳极的电极反应式:________________________________,写出阴极排出的溶液在碱性条件下吸收NO2的离子方程式:________________。
,请写出阳极的电极反应式:________________________________,写出阴极排出的溶液在碱性条件下吸收NO2的离子方程式:________________。
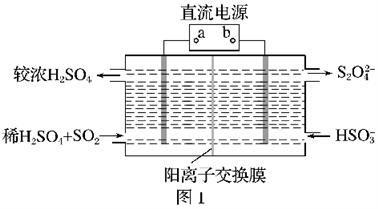
(2)活性炭具有催化和吸附作用,氮氧化物可以借助于活性炭来处理:C(s)+2NO(g) N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):
N2(g)+CO2(g)。为探究其催化效果,某化学兴趣小组在恒温(T1 ℃)条件下,将NO和足量的活性炭加入一恒容密闭的真空容器中,监测各物质的浓度并记录如下(忽略固体体积):
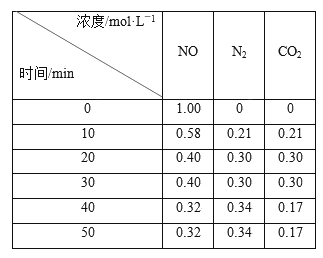
①分析表中数据,计算T1 ℃时该反应的化学平衡常数为________(保留两位小数)。
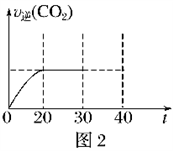
②30 min后,改变某一条件,反应重新达到平衡,如图2表示CO2的逆反应速率[v逆(CO2)]随反应时间(t)的变化关系图。请在图中画出在30 min时刻改变上述条件,在40 min时刻再次达平衡的变化曲线。________
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。






 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是





