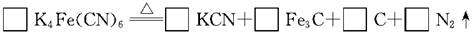-
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分【解析】
3K4[Fe(CN)6] 2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题:
(1)①基态Fe原子价电子排布图(轨道表示式)为_________________________
②C、N和O三种元素的第一电离能的大小顺序为_____________,原因是__________。
③IO3-的中心原子的杂化方式为______。一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63−中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,该立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
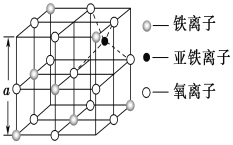
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
-
黄血盐[亚铁氰化钾,K4Fe(CN)6·3H2O]可用作食盐添加剂,一种制备黄血盐的工艺如下所示:
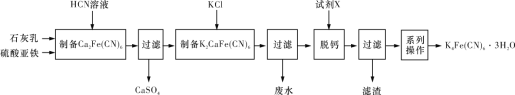
下列说法错误的是
A. HCN溶液有剧毒,含CN-的废水必须处理后才能排放
B. “废水”中含量较多的溶质为CaCl2
C. “试剂 X”可能是K2CO3
D. “系列操作”为蒸发结晶、过滤、洗涤、干燥
-
K4Fe(CN)6(亚铁氰化钾)可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛应用。以某电镀厂排放的含NaCN废液为主要原料制备K4Fe(CN)6的流程如下。已知:常温下,HCN的Ka=6.2×10-10,回答下列问题:
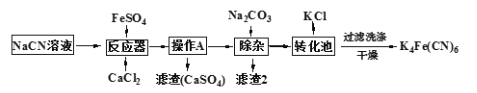
(1)HCN的电离方程式为______________;实验室配制一定浓度的NaCN溶液时,常将NaCN溶解于一定浓度的_______溶液中,加水稀释至指定浓度。
(2)反应器中发生的主要反应的化学方程式为______________。
(3)过滤后,洗涤K4Fe(CN)6使用的试剂为__________。
(4)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Ti2SO4中毒,试写出上述治疗Ti2SO4中毒反应的离子方程式为_____________。
(5)一种太阳能电池的工作原理如图,电解质为K3Fe(CN)6和K4Fe(CN)6的混合溶液。
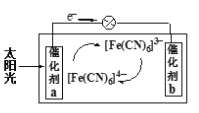
①则K+移向催化剂_________(填“a”或“b”);
②催化剂a表面发生的电极反应为____________。
-
亚铁氰化钾的化学式为K4Fe(CN)6,一种用含NaCN废水合成该化合物的主要工艺流程如下:
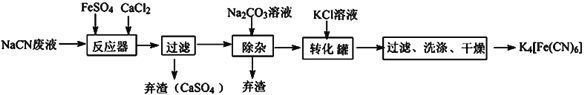
(1)请依据工艺流程图中的信息,回答下列问题:
①在“除杂”步骤中弃渣的主要成分为__________________(填化学式)。
②在“反应器“中发生的主要反应的化学方程式为:________________________________;
③相同温度下溶解度:Na4[Fe(CN)6]________K4[Fe(CN)6] (选填“>”、“<”或“=”)
(2)氰化钠(NaCN)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。NaCN 的电子式为__________________________;实验室用NaCN固体配制NaCN溶液时,应先将其溶于氢氧化钠溶液中,再用蒸馏水稀释。NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________________________。
(3)已知:氢氰酸是一种有苦杏仁气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5-8.5,用NaClO完全氧化OCN-生成N2和两种盐。
请写出第二步反应的离子方程式:_________________________________________。
②反应CN-+H2O HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
HCN+OH-在25℃时的平衡常数K=_____________(填数值)。
(4)K4Fe(CN)6与高锰酸钾溶液反应,其方程式为:
K4Fe(CN)6+KMnO4 +H2SO4=KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平), 若有1mol K4Fe(CN)6被高锰酸钾氧化时,则消耗KMnO4的物质的量为________mol。
-
亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:
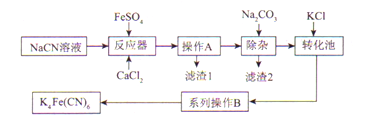
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
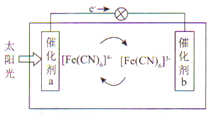
①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
-
亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
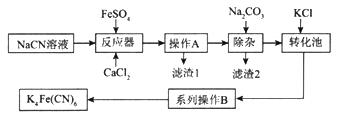
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
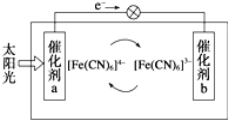
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
-
氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN 度液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN 的电离常数Ka=62×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN 溶解于一定浓度的NaOH 溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_________________。
(3)系列操作B 为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移 向 催 化 剂___________(填“a”或“b”)。
②催化剂a 表面发生的反应为_____________________。
-
(7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
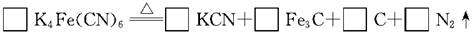
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______________(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______________mol。
-
黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg•kgˉ1.黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为
 .它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
.它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”).
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过400C时会分解,试配平该反应的化学方程式:______K4Fe(CN) ______KCN+______Fe3C+5C+3N2↑
______KCN+______Fe3C+5C+3N2↑
(3)黄血盐可与高锰酸钾溶液反应,其化学方程式为:
K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有______(填化学式).
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol.
-
黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),制备黄血盐的一种工艺如下:
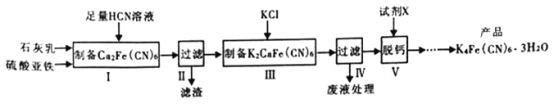
回答下列问题:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为__________________。
(2)步骤Ⅱ中滤渣的主要成分是_______________,步骤Ⅴ所用的试剂X可以是________________。
(3)步骤Ⅲ反应的化学方程式为_______________________________________。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。25℃时,Ka(HCN) =6.25×10-10。
①HCN的电子式为__________________。
②25℃时,反应CN-+H2O HCN+OH-的平衡常数K=_____________________。
HCN+OH-的平衡常数K=_____________________。
③含CN-废水的处理方法之一是:pH控制在11左右,用氯气将废水中CN-氧化成CO2和N2,该反应的离子方程式为_____________________________________。
(5)近日,一条“盐里面加进了亚铁氰化钾”危害身体健康的信息在网上流传。已知K4Fe(CN)6 4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
2(CN)2↑+12KCN+N2↑+Fe3C+C。请回答下列问题: