-
根据下列化合物:①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3•H2O ⑧H2O,回答下列问题.
(1)NH4Cl溶液显酸性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为  。
。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)若将等pH、等体积的②NaOH和⑦NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m n。(填“<”、“>”或“=”)
(4)若前五种溶液的物质的量浓度相同,用序号排出这五种溶液pH由大到小的顺序 。
-
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因______________,其溶液中离子浓度大小顺序为________________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除④⑦⑧外,若其余5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为:_________________(填序号)
-
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显__________性,用离子方程式表示原因 , 其溶液中离子浓度大小顺序为_________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀 释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(5)①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH,这5种溶液的物质的量浓度相同,则这5种溶液按 pH由大到小的顺序为:______________(填序号)
-
根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3•H2O⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(1)③溶液中离子浓度大小顺序为______________________。用离子方程式表示⑦溶液显碱性的原因_______________________________。
(2)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________。已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3•H2O CH3COO-+NH4++H2O的平衡常数为______________。
CH3COO-+NH4++H2O的平衡常数为______________。
(3)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(4)常温下,将0.10 mol/L的①溶液和0.30 mol/L;②溶液等体积混合,充分反应后恢复至常温,溶液的pH=________。
-
下列化合物:①HCl ②NaOH ③CH3COOH④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L HCl溶液的PH= ;
(3)常温下PH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(4)用离子方程式表示CH3COONa溶液呈碱性的原因 。
-
现有下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显_____________性,用离子方程式表示原因:_____________。其溶液中离子浓度大小顺序为__________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_____________mol/L;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_____________mol/L。
(3)已知纯水中存在如下平衡:H2O⇌H+OH-∆H>0。现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是____________填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m____________填“<”“>”或“=”)n。
(5)①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH这5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为_________________________填序号)。
-
下列化合物:①HCl、②NaOH、③CH3COOH、④NH3•H2O、⑤CH3COONa、⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号).
(2)常温下0.01mol/L HCl溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH﹣)= .
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m n (填“大于、等于、小于”).
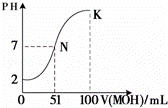
(4)常温下,向100mL 0.01mol•L﹣1HA溶液逐滴加入0.02mol•L﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①N点对应的溶液中,c(M+) c(A﹣)(填“大于、等于、小于”).
②K点对应的溶液中,c(M+)+c(MOH)= mol•L﹣1.
-
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有________(填序号)。
(2)常温下0.01mol·L-1 NaOH溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m________n(填“大于”、“等于”或“小于”)。
-
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有____________(填序号)。
(2)常温下0.01 mol/L HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。
HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。
(3)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m___________n (填“大于、等于、小于”)。
-
下列化合物:①HCl ②NaOH ③CH3COOH④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有__________(填序号)。
(2)常温下0.01 mol/L HCl溶液的pH=_________;
(3)常温下pH=11的CH3COONa溶液中由水电离产生的c(OH-) =__________。
(4)用离子方程式表示CH3COONa溶液呈碱性的原因_________________。
CH3COO-+NH4++H2O的平衡常数为______________。
