-
某小组同学研究SO2和KI溶液的反应,设计如下实验。
| 实验 | 操作 | 现象 |
| I | 
| 溶液迅速变为浅黄色,将溶液进行离心分离无固体沉积, 加入淀粉溶液,不变色 |
| II | 
| 溶液立即变成深黄色,将溶液进行离心分离有浅黄色固体沉积,溶液黄色变浅,加入淀粉溶液,不变色 |
(1)加入淀粉溶液的目的是______,为达到相同的目的,还可选用的试剂是______。
(2)经检验,II中的浅黄色固体是硫。资料显示,在酸性条件下,SO2和KI溶液反应生成S和I2。
① 在酸性条件下,SO2和KI溶液反应的离子方程式是______。
② 针对II中加入淀粉溶液不变色,甲同学提出假设:______。为证实该假设,甲同学取II中离心分离后的溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀生成。
③ 乙同学认为甲同学的实验方案不支持上述假设,理由是______。
④ 丙同学向1 mL 1 mol·L−1 KCl溶液中加入5滴1 mol·L−1盐酸,通入SO2,无明显实验现象,再加入盐酸酸化的BaCl2溶液,几乎没有白色沉淀。丙同学的实验结论是______。
(3)实验表明,I−是SO2转化的催化剂。补全下列离子方程式。
SO2+H2O ===_____ + +
(4)对比实验I和II,推测增大H+的浓度可加快SO2的转化速率。为证实该推测,还需进一步进行实验证明,实验方案是______。
-
资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
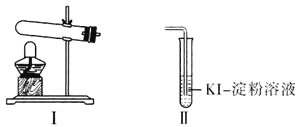
供选试剂: 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 
| 向Ⅰ试管中加入  固体, 固体, Ⅱ试管中加入适量  溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________, 组实验中
组实验中 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
对于实验 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
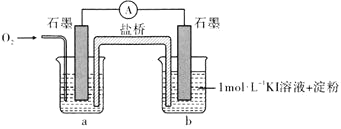
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后________。
后________。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是________
,褪色的原因是________ 用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验 的现象产生的原因可能是________。
的现象产生的原因可能是________。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
(资料):碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | 
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
-
某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
| 实验 | Ⅰ | Ⅱ |
| 装置 | 
| 
|
| 现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入 NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是______。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
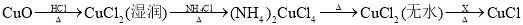
①(NH4)2CuCl4固体受热分解的化学方程式是______。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl。
反应方程式为:________________________________(补充完整)
ⅱ.X是______,理由是______。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是______(列出2点)。
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1 mol·L−1 NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和Cu(NH3)42+深蓝色
ⅱ.Cu(NH3)2+ Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+ Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或Cu(NH3)42+。
实验方案是______。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是______(列出1点即可)。
-
某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 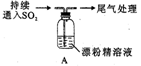
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。
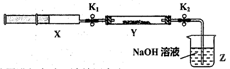
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
-
某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
| 实验 | 气体a | 编号及现象 |
| 
| HCl | Ⅰ.溶液迅速呈黄色 |
| SO2 | Ⅱ.溶液较快呈亮黄色 |
| CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 |
| 空气 | Ⅳ.长时间后,溶液无明显变化 |
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
| 电解时间/min | 溶液 | 阳极 | 阴极 |
| t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。
-
某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
| Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式 ________。
②艳艳同学认为不妥,补充实验Ⅲ:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
根据实验Ⅲ,可推断白雾成分是______,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
(资料)Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式 _______。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
| 实验编号 | 实验操作 | 实验现象 |
| Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
| Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
| Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
①实验Ⅴ的目的是 ______。
②通过以上实验,臧臧同学得出的结论是______。