-
氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:

装罝③仅有一个反应条件与①不同,该条件为_______________,实验②平衡时H2的转化率为_____________;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________kJ。(假设空气中氧气的体积含量为20%,产物为液态水)

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________.(已知:N2H4+H+ N2H5+ 的K=8.7×107;KW =1.0×10-14)
N2H5+ 的K=8.7×107;KW =1.0×10-14)
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.NH3的物质的量增加
D.平衡常数K增大
E.平衡向正方向移动
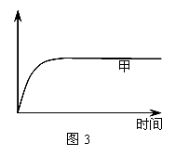
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g) ΔH=-92kJ·mol-1 ,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小 B.正反应速率加快,逆反应速率减慢
C.NH3的物质的量增加 D.平衡常数K增大
E.平衡向正方向移动
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。

(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
-
氨气是一种重要的基础化工原料,用途广泛.
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境.该反应的化学方程式为2NH3+3H2O2=______+6H2O
工业中常用以下反应合成氨:N2+3H2⇌2NH3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,C(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示.
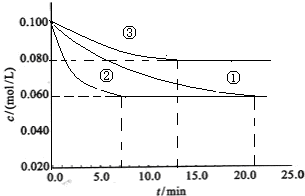
(1)该反应平衡常数的数学表达式______;实验②平衡时H2的转化率为______
(2)据图所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.
②条件:______理由:______
③条件:______理由:______.
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) △H<0。在1L蜜闭容器中加入0.1molN2和0.3molH2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) △H<0。在1L蜜闭容器中加入0.1molN2和0.3molH2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
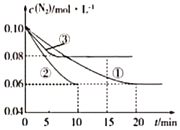
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=___;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的___(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

①达到平衡时,平衡常数K甲___K乙___K丙(填“>”“<“或“=”)。
②达到平衡时N2的浓度c(N2)甲___c(N2)乙,c(N2)乙___c(N2)丙(填“>”<”或“=”)
③对甲、乙、丙三容器的描述,以下说法正确的是___。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达到平衡状态
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
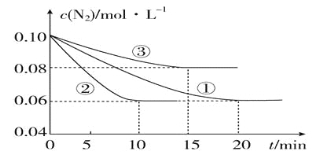
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的________、________(填字母编号)。
a.增大压强 b.减小压强 c.升高温度 d.降低温度 e.使用催化剂
(2)800 K时向下列起始体积相同的密闭容器中充入2 mol N2、3 mol H2,甲容器在反应过程中保持温度压强不变,乙容器保持温度体积不变,丙容器是绝热容器保持体积不变,三容器各自建立化学平衡。

①达到平衡时,平衡常数K甲________K乙________K丙(填“>”“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲________c(N2)乙,c(N2)乙________c(N2)丙(填“>”“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是____________。
| A.甲容器气体密度不再变化时,说明此反应已达到平衡状态 |
| B.在乙中充入稀有气体He,化学反应速率加快 |
| C.丙容器温度不再变化时说明已达平衡状态 |
| D.向丙容器中充入氨气,正向速率减小,逆向速率增大 |
-
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
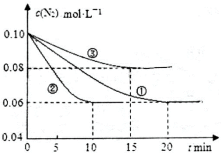
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项 中的______________、_____________(填字母编号)。
中的______________、_____________(填字母编号)。
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
-
氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2 2NH3。该可逆反应达到平衡的标志是________。
2NH3。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中,测得如下表所示数据。
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10 min内,CO的物质的量减少的原因可能是________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2 L的恒容密闭容器中同时充入0.2 mol CH4、0.6 mol H2O、a mol CO和0.5 mol H2,当a=0.2时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为________(已知:0.253=0.0156)
-
(11分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。
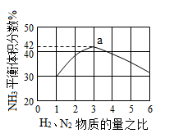
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
-
(13分)氮元素是地球大气中含量最多的元素。
(1)氮元素和碳元素一样也存在一系列氢化物并有广泛应用。例如:NH3、N2H4、N3H5、N4H6……。
①写出该系列氢化物的通式: 。
②N4H5Cl的同分异构体有 种。
(2)NH3、OH-、H2O结合质子(H+)的能力由强到弱的顺序是 ,其理由用两个反应的离子方程式表示为NH4++OH-= NH3+H2O和 。
(3)在碱性介质中,用N2H4与NO2可组合制成燃料电池,产物中无污染物,试写出该电池正极的电极反应式 。
(4)①CaCO3和适量稀HNO3溶液反应时,每产生4.4g气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为___________________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。
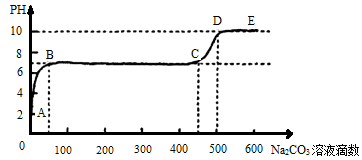
请用离子方程式表示B-C段发生的反应: 。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:


N2H5+ 的K=8.7×107;KW =1.0×10-14)











