-
甲醇是一种基础化工原料,可以用多种方法合成。
(1)用CO2生产甲醇。
已知:①CO2(g)+3H2(g)  CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
②2H2(g)+O2(g)═2H2O(l)△H=﹣b kJ•mol﹣1; (a、b均>0)
则表示CH3OH(g)燃烧的热化学方程式为:____________。
要使反应①在一定条件下建立的平衡逆向移动,可采取的措施有_______(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(2)用CO生产甲醇。
已知:CO(g)+2H2(g)  CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
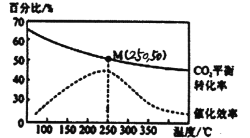
(3)CO2在工业上有多种用途,其中之一是合成低碳烯烃。在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
①图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是__________。
②250 ℃时,该反应的平衡常数K值为__________。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g) CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
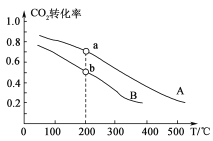
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。

A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
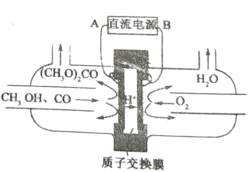
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
-
(12分)二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。
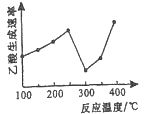
①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g) C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC O键
O键
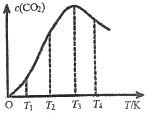
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
-
二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃烧热△H=___________。
(2)在催化剂作用下,CO2和CH4可直接转化为乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同温度下乙酸的生成速率变化如图所示。

①当温度在250℃—300℃范围时,乙酸的生成速率减慢的主要原因是_________。
②欲使乙酸的平衡产率提高,应采取的措施是_____________(任写一条措施即可)。
(3)一定条件下,在密闭容器中发生反应:2CO(g) C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.容器内混合物的质量不变 B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化 D.形成amolC=O键的同时断裂amolC O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,TC时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
-
二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。已知:
CO2(g) + 3H2(g) CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1
CH3OH(l) + H2O(l) ΔH1 = -131.0 kJ·mol−1
H2(g) + O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1
O2(g) = H2O(l) ΔH2 = -285.8 kJ·mol−1
则CH3OH的燃烧热ΔH =________________。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g) + CH4(g) CH3COOH(g) ΔH = +36.0 kJ·mol−1
CH3COOH(g) ΔH = +36.0 kJ·mol−1
欲使乙酸的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s) + CO2(g) 2CO(g)。
2CO(g)。
① 该反应的平衡常数表达式K =_____________。
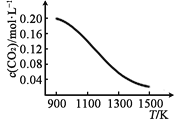
② 向容积为1 L的恒容容器中加入足量的碳和0.2 mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。则该反应为__________(填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2 mol CO2,达到新平衡后,体系中CO的百分含量______________(填“变大”或“变小”或“不变”,下同),平衡常数__________。
-
甲醇是一种基础的有机化工原料和优质燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可以合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
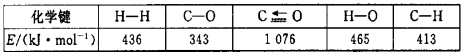
由此计算△H1=_________kJ·mol-1;已知△H2=-58 kJ·mol-1,则△H3=_______kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系是K2=________;随着温度的升高,K1______(填“减小”、“增大”或“不变”)。
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如下图左所示。图中压强由大到小的顺序为______________。
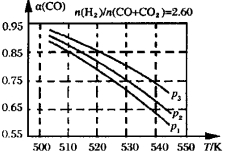
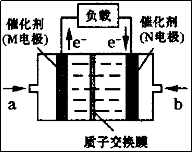
(4)上图右是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,甲醇在催化剂作用下提供质子(H+)和电子,电池总反应为:2CH3OH+3O2=2CO2+4H2O。一个甲醇分子经过电化学氧化,可以产生_______个电子的电量,其负极的电极反应式为_______________。
-
CO2 可用于合成多种化工原料。用 CO2 生产绿色燃料甲醇时发生反应A: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应 A 的平衡常数表达式是_____。在恒温恒容的密闭容器中进行该反应,下列说法正确的是_____(填字母)。
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2 的转化率
C.将初始投料增加 1 倍,可以提高CO2 的转化率
D.充入一定量的He 气,可以提高CO2 的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2 平衡转化率影响的曲线。
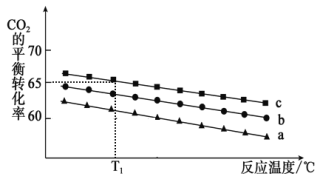
① 反应 A 的ΔH1_____0(填“>”或“<”)。
② 曲线 c 对应的投料是_____。
③ T1℃时,曲线c 对应的化学平衡常数_____1(填“大于”、“小于”或“等于”)。
(3)在一定条件下,利用 CO2 合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2 和H2 按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2 的转化率影响如图 2 所示。
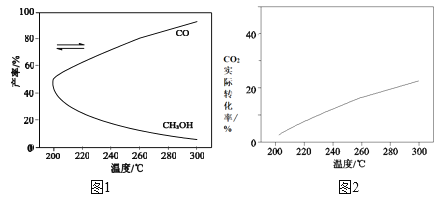
由图像可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_____。
(4)以 CO2 和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。
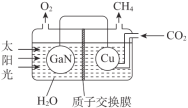
① GaN 电极上的电极反应式是_____。
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是_____L。
-
(题文)甲醇是重要的化工原料,CO和CO2均可用于合成甲醇。用CO2来生产甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
(1)已知:
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则CO(g)+ 2H2(g)=CH3OH(g) △H4=_______
(2)由CO合成甲醇时,CO的平衡转化率与温度和压强的关系如图所示。P点和Q点的平衡常数的大小KP____ KQ (填“大于”、“小于”或“等于”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________。

(3)一定温度下,向2 L密闭容器中加入1 mol CH3OH(g),发生反应CH3OH(g) =CO(g)+ 2H2(g),CO的体积分数随时间的变化如图所示。

①反应达到平衡状态的标志是___________。
A.气体的密度不变
B.气体的压强保持不变
C.υ正(CH3OH)=2υ正(H2)
D.υ正(H2)=2υ逆(CO)
②该温度下,CO(g)+ 2H2(g)=CH3OH(g)的平衡常数K=_________。
③若在t1时刻再加入1mol CH3OH(g),在t2 时刻重新达到平衡,请在图上画出CO的体积分数随时间变化的曲线(不要求计算具体数值,画出变化的趋势和范围即可)_______。
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。负极的电极反应式为_________________________。
-
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g)  CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
-
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H

已知:在25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式 .
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:
0~10min 内,氢气的平均反应速率为 mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
A.v正(CH3OH)=3v逆(H2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为 极,负极反应式为 .在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为 mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H 0(填“>”、“<”或“=”).
CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:


















