-
水溶液中存在多种平衡。
(1)下列性质中,可以证明醋酸是弱电解质的是_______。
A.0.1mol·L-1醋酸钠溶液呈碱性
B. 醋酸以任意比与水互溶
C. 10mL 1mol·L-1 醋酸恰好与10mL 1mol·L-1 NaOH溶液完全反应
D. 醋酸溶液的导电性比一元强酸溶液弱
(2)已知25℃时,0.1mol·L-1醋酸、0.1mol·L-1HA溶液的pH均为3,NH4A盐溶液呈中性, 则CH3COONH4溶液pH_____7(填“>”、“<”、“=”)。
(3)25℃时0.1mol·L-1 的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,继续做如下实验:向0.1mol·L-1 的醋酸溶液中加入少量下列物质中的______(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
②若_________(填“甲”或“乙”)的解释正确,溶液的pH应______(填“增大”“减小”或“不变”)。
(4)将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液。
①溶液中共有______种粒子。
②其中有两种粒子的物质的量之和一定等于0.010mol,它们是______和______。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=______mol。
高二化学综合题中等难度题查看答案及解析
-
醋酸的下列性质中,可以证明它是弱电解质的是
A. 0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L
B. 醋酸能与水以任何比例互溶
C. 10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 醋酸溶液的导电性比盐酸溶液的弱
【答案】A
【解析】0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L,说明醋酸只电离了一部分,所以是弱电解质,选项A正确。醋酸能与水以任何比例互溶是醋酸的物理性质,这个与电解质的强弱无关,选项B错误。10mL 1mol/L的一元酸(无论强弱)都会恰好与10mL 1mol/L NaOH溶液完全反应,所以选项C错误。因为没有说明浓度的关系,所以醋酸溶液的导电性比盐酸溶液的弱,并不能说明醋酸是弱电解质,选项D错误。
点睛:证明一个一元酸HA是弱电解质的方法主要有:
配成0.1mol/L的溶液,测得氢离子浓度小于0.1mol/L,或者测得pH>1。
测NaA的溶液的酸碱性,得到该溶液显碱性。
配成相同浓度的HA和HCl溶液,测得HA的导电性较差。
【题型】单选题
【结束】
16下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O
H2SO3+2OH-
高二化学单选题简单题查看答案及解析
-
醋酸的下列性质中,可以证明它是弱电解质的是( )
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥ B.②④⑥ C.①②④ D.②⑥
高二化学单选题中等难度题查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 醋酸的导电性比强酸溶液弱
高二化学单选题简单题查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 醋酸的导电性比强酸溶液弱
高二化学选择题简单题查看答案及解析
-
弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
醋酸在水溶液中的电离方程式为 ______________________。
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
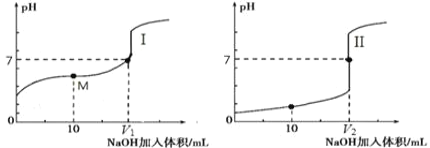
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1 的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________________。
④上述用 0.1 mol·L-1 的 NaOH 溶液滴定 0.1 mol·L-1 的盐酸,下列操作不正确的是____________________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定绝不能用___________作指示剂,若使用酚酞作指示剂则滴定终点的现象是_______________。
高二化学综合题简单题查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L
B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 醋酸是共价化合物
高二化学单选题简单题查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A.1mol/L的醋酸溶液中H+浓度约为10-3mol/L B.醋酸能与水以任意比互溶
C.10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D.醋酸的导电性比强酸溶液弱
高二化学单选题简单题查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L的醋酸溶液中H+浓度约为10-3mol/L
B.醋酸能与水以任意比互溶
C.10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D.醋酸的导电性比强酸溶液弱
高二化学选择题简单题查看答案及解析
-
下列事实能证明醋酸是弱电解质的是( )
①0.1mol / L 醋酸溶液的 pH=2.1
②醋酸能与水任意比例互溶
③10 mL 1 mol/L 的醋酸溶液恰好与 10 mL 1 mol/L的NaOH溶液完全反应
④相同条件下,醋酸导电性比盐酸弱
⑤醋酸与碳酸钠反应放出 CO2
A.①⑤ B.①④ C.②④ D.①④⑤
高二化学选择题中等难度题查看答案及解析