-
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
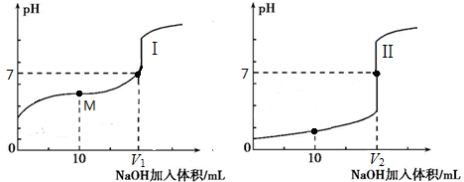
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
-
弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。
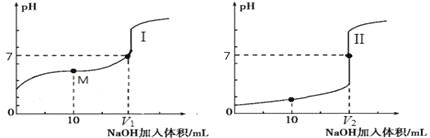
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1 的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1 的 NaOH 溶液滴定 0.1 mol·L-1 的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
-
弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。
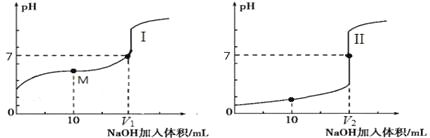
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1 的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1 的 NaOH 溶液滴定 0.1 mol·L-1 的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
-
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为______________。
②下列方法中,可以使醋酸稀溶液中CH3COOH 电离程度增大的是______(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
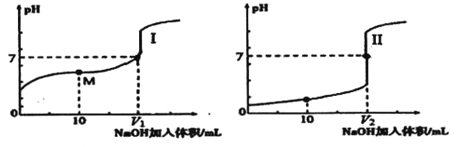
①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。
③V1和V2的关系: V1___V2 (填“>”、“=”或“<”)。
④M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料: AgSCN是白色沉淀,相同温度下,溶解度: AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1: 向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/L KSCN溶液,静置。 | 出现白色沉淀 |
| 步骤2: 取1mL上层清液于试管中,滴加1滴2mol/L Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3: 向步骤2 的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅。 |
| 步骤4: 向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式_____________。
②步骤3中现象a是_____________。
③用化学平衡原理解释步骤4 的实验现象___________。
-
弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
醋酸在水溶液中的电离方程式为 ______________________。
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
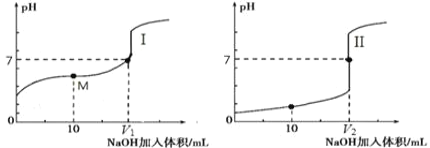
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1 的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________________。
④上述用 0.1 mol·L-1 的 NaOH 溶液滴定 0.1 mol·L-1 的盐酸,下列操作不正确的是____________________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定绝不能用___________作指示剂,若使用酚酞作指示剂则滴定终点的现象是_______________。
-
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
| 待测液体积/mL | 标准NaOH溶液 |
| 滴定前读数/mL | 滴定终点读数/mL |
| 第1次 | 20.00 | 0 | 21.98 |
| 第2次 | 20.00 | 0 | 22.00 |
| 第3次 | 20.00 | 0 | 22.02 |
-
电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________(填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
| 待测液体积/mL | 标准NaOH溶液 |
| 滴定前读数/mL | 滴定终点读数/mL |
| 第1次 | 20.00 | 0 | 21.98 |
| 第2次 | 20.00 | 0 | 22.00 |
| 第3次 | 20.00 | 0 | 22.02 |
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L−1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
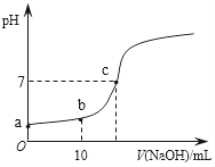
(6)a点溶液pH > 1,用电离方程式解释原因:_____________。
(7)下列有关b点溶液的说法正确的是_______(填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH−)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________。
-
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
| 待测液体积/mL | 标准NaOH溶液 |
| 滴定前读数/mL | 滴定终点读数/mL |
| 第1次 | 20.00 | 0 | 21.98 |
| 第2次 | 20.00 | 0 | 22.00 |
| 第3次 | 20.00 | 0 | 22.02 |
-
弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
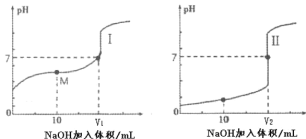
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
| 甲 | 乙 |
| pH | 11 | 11 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2: +SO2+H2O=
+SO2+H2O= +
+
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
-
电解质的水溶液中存在离子平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为__________________。
②下列方法中,可以使醋酸稀溶液中CH3COOH的电离程度增大的是________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线。
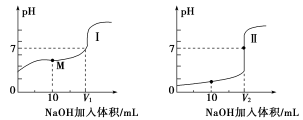
①滴定醋酸溶液的曲线是________(填“Ⅰ”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是________。
③V1和V2的关系:V1________V2(填“>”“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。







