-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g)+ 5O2 (g) 4NO (g)+ 6H2O (g)△H = -9072kJ·mol-1 K=1.1×1026
4NO (g)+ 6H2O (g)△H = -9072kJ·mol-1 K=1.1×1026
② 4NH3 (g)+ 4O2 (g) 2N2O (g)+ 6H2O (g)△H=-1104.9kJ·mol-1 K=4.4×1028
2N2O (g)+ 6H2O (g)△H=-1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g)+ 3O2 (g) 2N2 (g)+ 6H2O (g)△H=-1269.02kJ·mol-1 K=7.1×1034
2N2 (g)+ 6H2O (g)△H=-1269.02kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是
A.增大O2浓度 B.使用合适的催化剂 C.减小压强 D.降低温度
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g)  4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g)  2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g)  2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g)  4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
② 4NH3 (g) + 4O2 (g)  2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g) + 3O2 (g)  2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列说法正确的是
A.增大压强,则反应的②K不变,反应①和③的K减小
B.500℃时,2NH3 (g) + 2O2 (g)  N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃时,N2 (g) + O2 (g)= 2NO (g) △H = +181 kJ·mol-1
D.500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
4NH3(g) + 5O2(g) 4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NH3(g) + 4O2(g) 2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
4NH3(g) + 3O2(g) 2N2(g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2(g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列说法正确的是
A.增大压强,则反应的②K不变,反应①和③的K减小
B.500℃时,2NH3 (g) + 2O2(g) N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃时,N2(g) + O2(g)=2NO (g) △H = +181 kJ·mol-1
D.500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ
-
硝酸生产中,500 ℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
②4NH3(g)+4O2(g)  2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
③4NH3(g)+3O2(g)  2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
A.增大O2浓度
B.使用合适的催化剂
C.减小压强
D.降低温度
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-9072kJ·mol-1K=1.1×1026
4NO(g)+6H2O(g)△H=-9072kJ·mol-1K=1.1×1026
②4NH3(g)+4O2(g) 2N2O(g)+6H2O(g)△H=-1104.9kJ·mol-1K=4.4×1028
2N2O(g)+6H2O(g)△H=-1104.9kJ·mol-1K=4.4×1028
③4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H=-1269.02kJ·mol-1K=7.1×1034
2N2(g)+6H2O(g)△H=-1269.02kJ·mol-1K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是()
A.增大O2浓度 B.使用合适的催化剂 C.减小压强 D.降低温度
-
(9分)氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
⑴①该反应的熵变△S________0(填“>”、“<”或“=”)。
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H________0(填“>”、“<”或“=”)。
⑵若其他条件不变,下列关系图错误的是________(选填序号)。
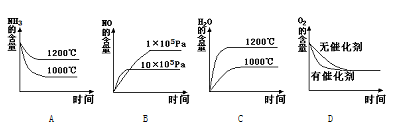
⑶在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第 2 min | 3.2 | | 0.8 | 1.2 |
| 第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①反应在第 2 min 到第 4 min 时,反应速率υ(O2) =________;
②反应在第 2 min 时改变了条件,改变的条件可能是________。
该条件下,反应的平衡常数K=________(只写计算结果,不标单位)。
-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:
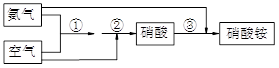

其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:


其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
-
在一定条件下密闭容器中发生: 4NH3(g) + 5O2(g)  4NO (g)+ 6H2O(g)
4NO (g)+ 6H2O(g)
反应过程中能量变化如图所示;下列说法正确的是
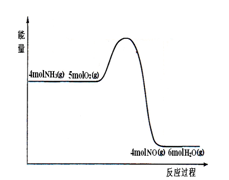
A.由图可知,该反应的正反应是吸热反应
B.升高温度可以提高NH3的转化率
C.反应体系中加入催化剂可增加反应热
D.将平衡混合物通入水中一定有硝酸铵生成
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2(g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
N2O (g) + 3H2O (g) K=2.2×1028


