-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:

其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:


其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
-
(9分)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
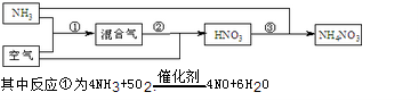
(1)步骤②发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为 。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c,硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是 。(用含a,b,c的表示式)。
-
硝酸是重要的化工原料,工业上用氨催化氧化法生产硝酸,反应如下:
①氧化炉:4NH3+5O2=4NO+6H2O
②吸收塔:4NO+3O2+2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80。完成下列计算:
(1)1mol NH3完全转化为NO至少需要空气______mol。工业上先将氨气和空气混合好,在氧化炉反应后直接通入吸收塔中用冷水吸收,为了确保吸收效果,第②步反应要求氧气至少过量20%,计算起始时空气与氨气的体积比至少为______
(2)硝酸工业产生的氮氧化物尾气(NO和NO2),可用烧碱吸收,反应如下:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
现有含0.5mol氮氧化物的尾气,用8mol/L的NaOH溶液完全吸收,吸收后的溶液中c(OH﹣):c(NO2﹣):c(NO3﹣)=5:4:1。所用NaOH溶液的体积为______mL。若将尾气中NO与NO2的平均组成记为NOx,则x=______
(3)工业上用硝酸与氨气反应制取硝酸铵:HNO3+NH3=NH4NO3,反应时NH3的吸收率为97%,硝酸的利用率为98%。在用氨气制取硝酸时,氨气的利用率为90%。计算生产80吨的硝酸铵共需氨气__吨?(保留1位小数)
-
工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
-
下面涉及的是工业生产硝酸铵的过程。
(1)写出NO2和水反应的化学方程式,并标出电子转移的方向和数目。。
(2)已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:________,
氨催化氧化生成NO反应的化学平衡常数表达式K=________。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有________。(填字母)
2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有________。(填字母)
A.升高温度 B.使用催化剂
C.及时移出氨 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为________。
(5)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池。
例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2 + O2 →2CH3CHO可设计成燃料电池:
正极为:O2+4H++4e-=2H2O 负极为: ________
电池工作时,负极附近溶液的pH________(填“升高”、“降低”或“不变”)。
-
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):

(1)反应④的化学方程式为3NO2+H2O====2HNO3+NO,该反应的氧化剂为 ,还原剂为 。
(2)补充并配平反应②的化学方程式:
NH3+ O2 NO+ 。
NO+ 。
(3)化学反应 (填序号)是非氧化还原反应,离子方程式为 。
(4)有人设计了一个反应来制备硝酸:NO2+NH3 HNO3+H2O(未配平),你认为该反应
HNO3+H2O(未配平),你认为该反应
(填“能”或“不能”)发生,理由是 。
-
工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
①4NH3+5O2→4NO+6H2O
②4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为______(保留2位小数).
(2)现将1mol的氨气与12mol的空气混合反应,可得到硝酸______mol;
(3)向上述溶液中加入______mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液.
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol.在得到硝酸的条件下,写出x与y的关系式.(写出解题过程)
-
工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
①4NH3+5O2→4NO+6H2O
②4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为______(保留2位小数).
(2)现将1mol的氨气与12mol的空气混合反应,可得到硝酸______mol;
(3)向上述溶液中加入______mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液.
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol.在得到硝酸的条件下,写出x与y的关系式.(写出解题过程)
-
已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀) 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | |
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。



