-
工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
高三化学计算题中等难度题查看答案及解析
-
硝酸是重要的化工原料,工业上用氨催化氧化法生产硝酸,反应如下:
①氧化炉:4NH3+5O2=4NO+6H2O
②吸收塔:4NO+3O2+2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80。完成下列计算:
(1)1mol NH3完全转化为NO至少需要空气______mol。工业上先将氨气和空气混合好,在氧化炉反应后直接通入吸收塔中用冷水吸收,为了确保吸收效果,第②步反应要求氧气至少过量20%,计算起始时空气与氨气的体积比至少为______
(2)硝酸工业产生的氮氧化物尾气(NO和NO2),可用烧碱吸收,反应如下:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
现有含0.5mol氮氧化物的尾气,用8mol/L的NaOH溶液完全吸收,吸收后的溶液中c(OH﹣):c(NO2﹣):c(NO3﹣)=5:4:1。所用NaOH溶液的体积为______mL。若将尾气中NO与NO2的平均组成记为NOx,则x=______
(3)工业上用硝酸与氨气反应制取硝酸铵:HNO3+NH3=NH4NO3,反应时NH3的吸收率为97%,硝酸的利用率为98%。在用氨气制取硝酸时,氨气的利用率为90%。计算生产80吨的硝酸铵共需氨气__吨?(保留1位小数)
高三化学解答题困难题查看答案及解析
-
(本题共14分)硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3 ----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数
是 (保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是 mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?(写出计算过程)
高三化学计算题极难题查看答案及解析
-
工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2
4NO+6H2O① 4NO+3O2+2H2O=4HNO3②
(1)现以1.7吨液氨为原料来生产质量分数为50%的硝酸,理论上至少需要加水的质量为吨。(假设生产过程中反应物和生成物均无损耗)
(2)工业上用Mg(NO3)2替代浓H2SO4可作为制取浓HNO3的脱水剂,现有50%(质量分数,下同)的硝酸M1吨,向其中加入80%的Mg(NO3)2溶液M2吨,蒸馏分离得到90%的硝酸和60%的Mg(NO3)2溶液(不含HNO3)。若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,则蒸馏前的投料比M1/M2=。
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3=NaNO2 + NaNO3 + CO2③,NO + NO2 + Na2CO3=2NaNO2 + CO2④。现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g。
求硝酸工业尾气中NO和NO2的物质的量之比?
高三化学填空题中等难度题查看答案及解析
-
工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
①4NH3+5O2→4NO+6H2O
②4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为______(保留2位小数).
(2)现将1mol的氨气与12mol的空气混合反应,可得到硝酸______mol;
(3)向上述溶液中加入______mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液.
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol.在得到硝酸的条件下,写出x与y的关系式.(写出解题过程)高三化学解答题中等难度题查看答案及解析
-
工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
①4NH3+5O2→4NO+6H2O
②4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为______(保留2位小数).
(2)现将1mol的氨气与12mol的空气混合反应,可得到硝酸______mol;
(3)向上述溶液中加入______mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液.
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol.在得到硝酸的条件下,写出x与y的关系式.(写出解题过程)高三化学解答题中等难度题查看答案及解析
-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:
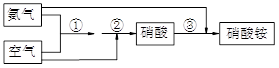
其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
高三化学计算题简单题查看答案及解析
-
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:
其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
高三化学计算题困难题查看答案及解析
-
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________(写出计算过程)
高三化学计算题中等难度题查看答案及解析
-
氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ
NO
O2
N2
629
496
942
则△H2=___________。
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:
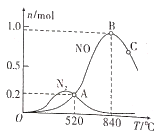
①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
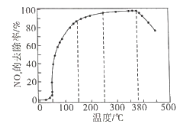
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。
高三化学综合题困难题查看答案及解析