-
已知:下表为25 ℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
右侧图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
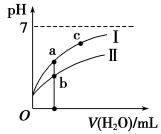
A.25℃时,相同浓度的CH3COONa溶液的碱性大于NaClO溶液
B.向NaClO溶液中通入少量二氧化碳的离子方程式为
2ClO-+CO2+H2O===2HClO+CO
C.图像I代表CH3COOH溶液的稀释
D.图像中a点酸的总浓度大于b点酸的总浓度
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
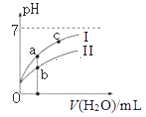
A.Ⅰ曲线代表 HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
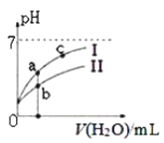
图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中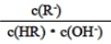 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )

A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
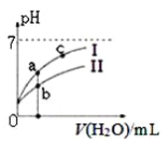
图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:
2ClO-+CO2+ H2O = 2HClO+CO32-
C. 图像中a、c两点处的溶液中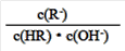 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
-
下表是几种常见弱酸的电离平衡常数(25℃ )
| 化学式 | H2CO3 | CH3COOH | HClO |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 1.8×10-5 | 3.0×10-8 |
(1)根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是_____________________________________。
(2)常温下,0.1mol•L﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+) B. C.c(H+)•c(OH﹣) D.
C.c(H+)•c(OH﹣) D. E.
E.
(3)25℃时,等浓度的Na2CO3、CH3COONa和NaClO三种溶液的pH从小到大依次是_____________________________________。
(4)25℃时,将a mol∙L﹣1的醋酸与b mol∙L﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,溶液中离子浓度大小关系:_________________
(5)下列反应不能发生的是______(填字母)。
a. +2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c. +2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=
+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O= +2HClO
+2HClO
-
(1)下表是几种常见弱酸的电离平衡常数(25℃)
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。
-
25 ℃时某些弱酸的电离平衡常数如下表所示:
| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
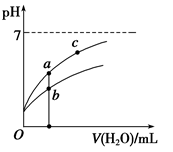
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
-
表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:
c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时:
c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
-
表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后



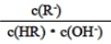 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
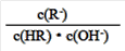 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
