-
(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
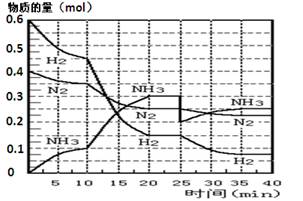
回答下列问题:
(1)10 min内以NH3表示的平均反应速率________;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ________;
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:________,第2次平衡的时间范围为:________,
第1次平衡:平衡常数K1 = ________(带数据的表达式),第2次平衡时NH3的体积分数 ________;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:________
② 达第二次平衡时,新平衡的平衡常数K2 ________ K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= ________。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) +  O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:________
-
(16分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
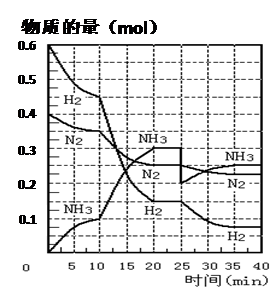
(1)10 min内以NH3表示的平均反应速率________;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ________;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:________,第2次平衡的时间范围为:________,第1次平衡:平衡常数K1 = ________(带数据的表达式),第2次平衡时NH3的体积分数 ________;
(4)在反应进行至25 min时:① 曲线发生变化的原因:________② 达第二次平衡时,新平衡的平衡常数K2 ________ K1(填“大于”、“等于”、“小于”)
-
(27分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
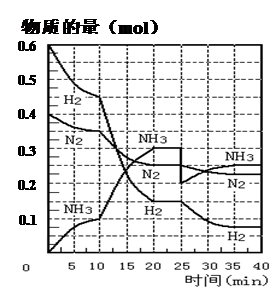
(1)10 min内以NH3表示的平均反应速率________;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ________;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:________,
第2次平衡的时间范围为:________,
第1次平衡:平衡常数K1 = ________(带数据的表达式),
第2次平衡时NH3的体积分数 ________;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:________
② 达第二次平衡时,新平衡的平衡常数
K2 ________ K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= ________。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) +  O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
-
氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
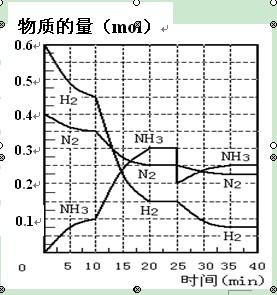
(1)10 min内以NH3表示的平均反应速率________;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ________;
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:________平衡常数K1 ="_____________" ________(表达式),第2次平衡时NH3的体积分数 ________;
(4)在反应进行至25 min时, 曲线发生变化的原因:________
-
氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率______;
(2)在10~20min内:NH3浓度变化的原因可能是______;
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:______平衡常数K1=______(表达式),第2次平衡时NH3的体积分数______;
(4)在反应进行至25min时,曲线发生变化的原因:______.
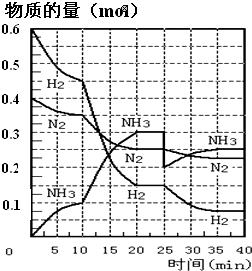
-
氨是重要的氮肥,合成原理为: N2(g)+3H2(g) 2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
(1)10 min内以NH3表示的平均反应速率:______;
(2)在10 ~20 min内:NH3浓度变化的原因可能是______________
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的平衡常数K1 = _________________(带数据的表达式),第2次平衡时NH3的体积分数=___________(小数点后保留一位);
(4)在反应进行至25 min时:①曲线发生变化的原因______________,② 达第二次平衡时,新平衡的平衡常数K2 ____ K1(填“大于”“等于”或“小于”)。
-
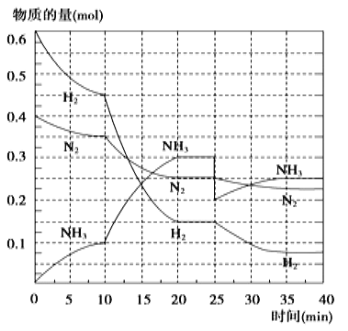
氨是重要的氮肥,合成原理为: N2(g)+3H2(g) 2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
(1)10 min内以NH3表示的平均反应速率:______;
(2)在10 ~20 min内:NH3浓度变化的原因可能是______________
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的平衡常数K1 = _________________(带数据的表达式),第2次平衡时NH3的体积分数=___________(小数点后保留一位);
(4)在反应进行至25 min时:①曲线发生变化的原因______________,② 达第二次平衡时,新平衡的平衡常数K2 ____ K1(填“大于”“等于”或“小于”)。
-
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
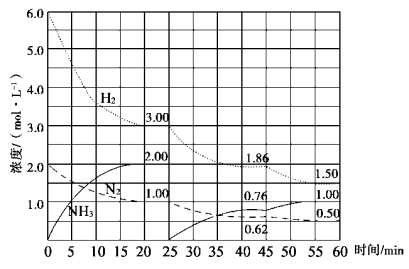
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

-
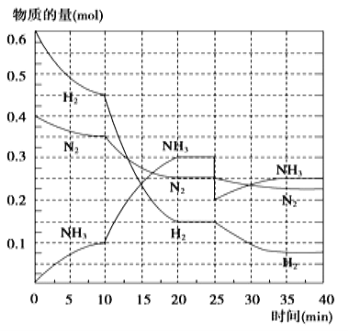
氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
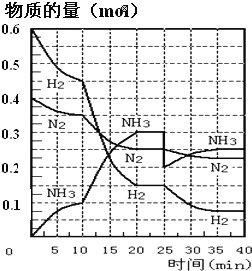
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________(带数据的表达式),第2次平衡时NH3的体积分数为_____________。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a______0,△S_______0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l)∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________
-
下列事实,其中不能用平衡移动原理解释的是
A.500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
B.在恒容密闭容器中充入一定量NO2建立2NO2(g) N2O4(g)△H<0
N2O4(g)△H<0
C.向水中投入金属Na,最终溶液呈碱性
D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。

2NH3(g) +
O2(g) ;△H = a kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1








