-
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
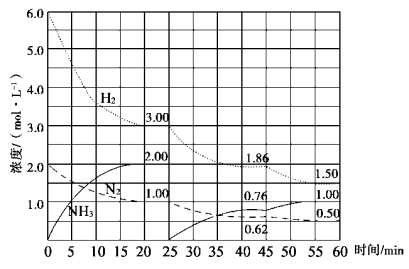
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

-
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g) NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
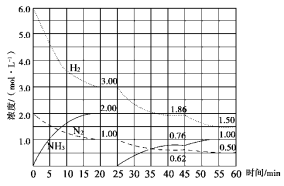
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是________ 。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。

-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2 (g) + 3H2 (g)  2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
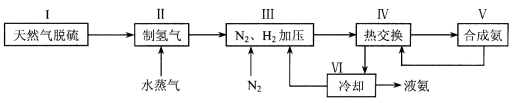
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(2)步骤Ⅱ中制氢气原理如下:
① CH4 (g) + H2O (g)  CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
② CO (g) + H2O (g)  CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
写出氢气和二氧化碳气体反应生成甲烷和水蒸气的热化学方程式 。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) 。
(4)用氨气制取尿素[CO(NH2)2]的反应为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH<0
CO(NH2)2(l)+H2O(g) ΔH<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。若保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应(0~70s)的进程曲线。

(5)25℃时,向a mol NH4NO3固体中滴加b L氨水后溶液恰好呈中性,所滴加氨水的浓度为 mol·L-1(25℃时,NH3·H2O的电离平衡常数Kb=2×10-5)
-
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
(1)实验室中常用来制备氨气的化学方程式为 。
(2)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式 _。
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________________(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为_____________mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5)。
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2 ]:CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡。反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
①20min时v正(CO2)_________80min时v逆(H2O)(填“>”、“=”或“<”)。在t℃时,该反应的平衡常数K= 。
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将_________(填“增大”、“不变”或“减小”)。
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是 (填图甲中的“A”或“B”)。
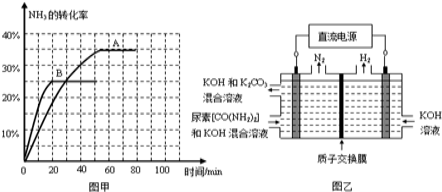
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气。该装置中阳极的电极反应式为______ ,若两极共收集到气体22.4L(标况),则消耗的尿素为______g(忽略气体的溶解)。
-
科学家一直致力于“人工固氮”的新方法研究。
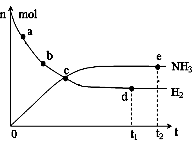 (1)目前合成氨技术原理为:N2(g) + 3H2(g)
(1)目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);
2NH3(g);
△H=—92.4kJ·mol—1。
① 673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随
时间变化的关系如右图所示。下列叙述正确的是。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
② 在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g) + 3H2(g)  2NH3(g)的平衡常数K=。K值越大,表明反应达到平衡时。(填标号)。
2NH3(g)的平衡常数K=。K值越大,表明反应达到平衡时。(填标号)。
A.化学反应速率越大 B.NH3的产量一定越大 C.正反应进行得越完全
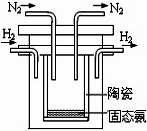 (2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电
解合成氨。其实验装置如图,阴极的电极反应式。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,
N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1)  2NH3(g) +
2NH3(g) +  O2(g) △H = a kJ·mol—1
O2(g) △H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a________0;ΔS________0(填“>”、“<”或“=”);该反应属于________
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则N2(g) + 3H2O(1) = 2NH3(g) +  O2(g) ΔH=________kJ·mol—1。
O2(g) ΔH=________kJ·mol—1。
-
(14分,每空2分)
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是_______ (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g) 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | --------- |
| 实验2 | 5 | 5 | 40 | 25 | ---------- |
| 实验3 | 5 | 5 | V2 | 0 | ----------- |
该实验的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反应C(s)+H2O(g)  H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。
①图中t4到t6段时引起平衡移动的条件可能是________;
②图中表示平衡混合物中CO的含量最高的一段时间是________。

-
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
据此回答以下问题:
(1)从化学平衡角度考虑,为了提高氨气的产率,可以选择的方法是______(填序号,错选扣分).
①升高温度 ②增大压强 ③使用催化剂 ④及时分离出NH3
(2)对在恒容密闭容器中进行的可逆反应:N2(g)+3H2(g)⇌2NH3(g),下列选项中说明该反应已经达到化学平衡状态是:______.(填序号).
①N2的消耗应速率是NH3的消耗速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是______(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
-
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
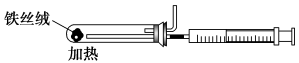
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
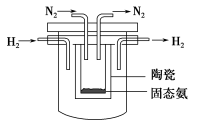
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
-
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I. 该反应 N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
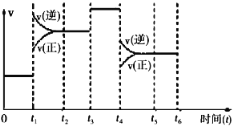
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1___________,t3____________,t4__________。
(2)下列时间段中,氨的百分含量最高的是__________
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
II. 在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(2)缩小体积增大压强,混合气体的平均相对分子质量________ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持总压强不变,平衡将___________(填“正向”、“逆向”或“不移动”)。
(4)已知合成氨的反应在298K时:正反应的△H=-92.4kJ/mol,△S=-0.1982kJ/(mol·K),根据焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(5)若容器恒容、绝热,该反应达到平衡的标志是___________
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V正(N2) =V正(NH3)
⑦单位时间内3mol H-H断裂同时2mol N-H也断裂.
-
氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是_____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将______ (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”“小于”或“等于”)原来的2倍。
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:







 (1)目前合成氨技术原理为:N2(g) + 3H2(g)
(1)目前合成氨技术原理为:N2(g) + 3H2(g) (2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性


