-
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应_______。若构建原电池时两个电极的质量相等,当导线中通过0.05 mol电子时,两个电极的质量差为________。
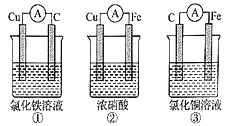
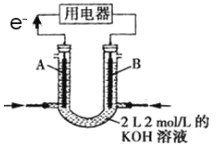
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
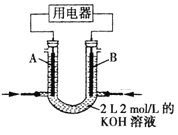
①实验测得OH-定问移向B 电极,则_____处电极入口通甲烷(填A或B),其电极反应式为___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
(3)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol 电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol 电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。
-
电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05 mol电子时,两个电极的质量差为________。
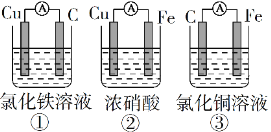
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
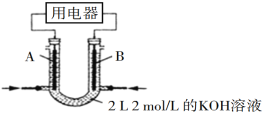
实验测得OH−定问移向B 电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
-
(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
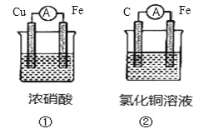
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。
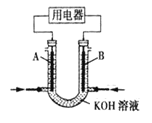
实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
-
电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证与 和
和 的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过
的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过 电子时,两个电极的质量差为____________________。
电子时,两个电极的质量差为____________________。

(2)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
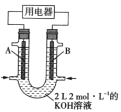
实验测得电池工作时 向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
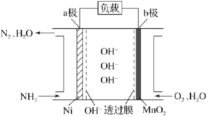
①a极是电池的____________________(填“正”或“负”)极,电极反应式为_______________________。
②当生成 时,电路中通过的电子的物质的量为____________________。
时,电路中通过的电子的物质的量为____________________。
-
(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______。
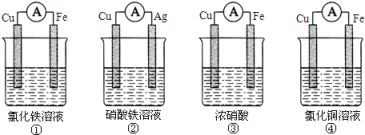
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
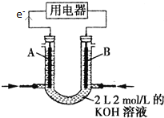
A处其电极反应式为___________;
(3)某元素的同位素 ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
(4)将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s) NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g) Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测知c(H2)=0.5mo/L,c(HBr)=4mol/L。若上述反应速率用v(NH3)表示,则v(NH3)=_____
-
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
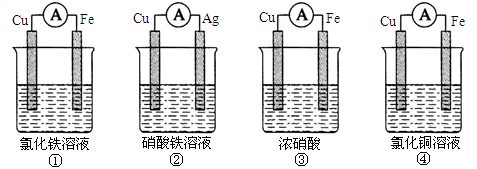
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
-
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。

(1)写出电极反应式,负极:___________________。正极:__________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)。
(3)Cu2+、Fe3+的氧化性由强到弱的顺序为:___________。
(4)该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的物质的量是_________。
-
请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式。
(1)负极 __________________________
(2)正极 __________________________________
(3)并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路中电子流向。________________________________
-
任何一个化学反应中都会伴随能量变化和物质变化。
(1)请根据离子反应:Fe +Cu2+==Fe2++ Cu,设计一个原电池。电解质溶液为______;写出负极电极反应式:______;
(2)为了验证 Fe3+与 Cu2+氧化性强弱,下列装置能达到实验目的的是______;
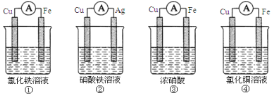
(3)将 H2设计成燃料电池,其总利用率比直接燃烧更高,装置如下图所示(A、 B 为多孔碳棒)。______处电极入口通 H2(填 A 或 B),其电极反应式为______。
-
为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
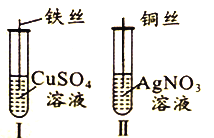
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
| 实验编号 | 实验现象 | 实验结论 |
| Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
| Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。


3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为__________;放电时每转移3mol 电子,有_____mol K2FeO4被还原,正极附近溶液的碱性________(填“增强”。“不变“或“减弱”)。













