-
(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。

③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
| A.实验装置保温、隔热效果差 |
| B.量取NaOH溶液的体积时仰视读数 |
| C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
-
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
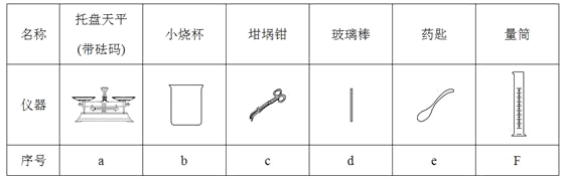
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________ 。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 
| 
| 
| 
| 
| 
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

(1)此装置哪些地方需要改进:________________
(2)写出该反应的中和热的热化学方程式(中和热为57.3 kJ·mol-1):__________________
(3)取50 mL NaOH溶液和30 mL硫酸溶液按正确装置进行实验,实验数据如下表。
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
| | | | | |
①近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=_______________(取小数点后一位)。
②上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)如果用50 mL 0.55 mol·L-1的氨水代替NaOH溶液进行上述实验,其放出的热量偏小,原因是________________________
-
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是 (填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 
| 
| 
| 
| 
| 
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
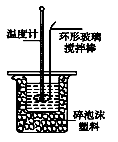
(3)写出该中和反应的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| | | | | |
上表中的温度差平均值为 ℃
近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图6中选择称量NaOH固体所需要的仪器是(填字母): 。

Ⅱ.测定中和热的实验装置如图7所示。
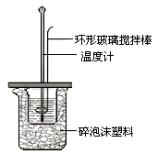
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 (中和热数值为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
| | | | | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。

①图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________。
-
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。(2分)
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 
| 
| 
| 
| 
| 
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。

(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和_____________________。泡沫塑料的作用是______________
(2)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_______________________________________
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______________________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体______g。
(2)配制0.50 mol/L NaOH溶液必须用到的仪器有:天平(带砝码)、烧杯、玻璃棒、__________和____________。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
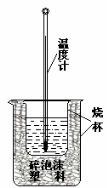
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和_________________。泡沫塑料的作用是 。
(2)写出该反应的热化学方程式(中和热ΔH= -57.3 kJ/mol):_______________________________。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验次数] | 起始温度t1/ oC] | 终止温度t2/ oC] | 温度差平均值(t2-t1)/ oC] |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
| | | | | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________ kJ/mol (取小数点后一位)。
③上述实验数值结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体__g.
(2)从图1中选择称量NaOH固体所需要的仪器是(填字母):__.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 
| 
| 
| 
| 
| 
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定中和热的实验装置如图2所示.
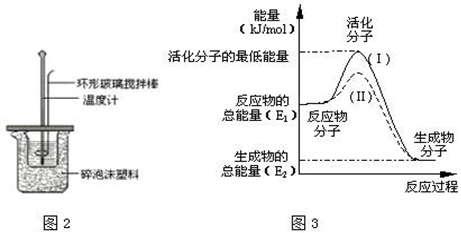
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__(中和热数值为57.3kJ/mol)。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2﹣t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
| | | | | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=__(取小数点后一位).
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察3图,然后回答问题.
①图中所示反应是__(填“吸热”或“放热”)反应,该反应的△H=__(用含E1、E2的代数式表示).
②对于同一反应,图3中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是__.
-
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
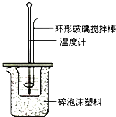
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g。
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):___。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 
| 
| 
| 
| 
| 
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):___。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写下表中的空白:
| 
| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.3 |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
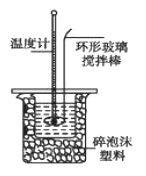
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
| | | | | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液。
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):________。
Ⅱ.测定稀硫酸和稀NaOH中和热的实验装置如下图所示。
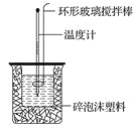
(1)写出该反应的热化学方程式(中和热ΔH=-57.3 kJ·mol-1): _______________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
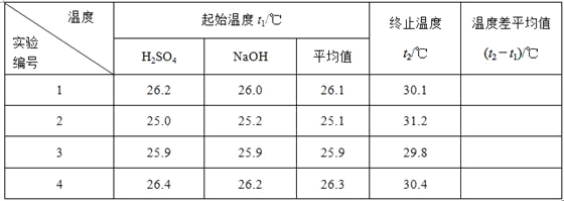
1_______________2___________________3_______________________4________________________5温度差平均值____
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度


 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液













