-
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
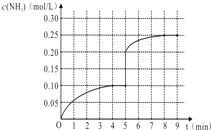
(1)该反应的化学平衡常数表达式为 ______ ;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= ______ .
(3)该反应达到平衡状态的标志是 ______ (填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 _____。
-
(6分)在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
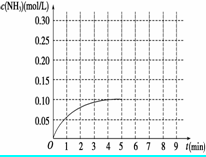
(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度 不可能为( )
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡________移动________(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_________(填“增大”、“减小”或“不变”)
-
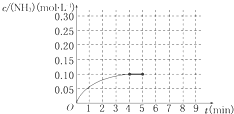
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据如图,计算从反应开始到平衡时,平衡反应速率v(NH3)为______ mol/.
(2)该反应达到平衡时H2的转化率______.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.(填序号)
a.0.20mol•L-1 b.0.12mol•L-1 c.0.10mol•L-1 d.0.08mol•L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______移动(填“向逆反应方向”、“向正反应方向”或“不”).
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡,请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
-
在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
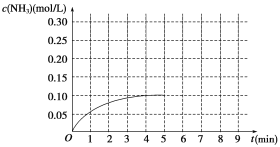
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
-
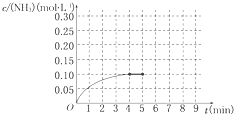
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据如图,计算从反应开始到平衡时,平衡反应速率v(NH3)为______ mol/.
(2)该反应达到平衡时H2的转化率______.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.(填序号)
a.0.20mol•L-1 b.0.12mol•L-1 c.0.10mol•L-1 d.0.08mol•L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______移动(填“向逆反应方向”、“向正反应方向”或“不”).
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡,请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
-
在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
-
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:

(1)该反应的化学平衡常数表达式为______;
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为______.
(3)判断该反应达到平衡状态的标志是______(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.
a.0.20mol/L b.0.12mol/Lc.0.10mol/L d.0.08mol/L.
-
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)平衡常数的表达式K=__________,该反应450℃的平衡常数__________500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是__________
A.3υ正(H2)=2υ逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率υ(N2)为__________mol/(L·min),NH3的体积分数__________
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式:__________;
(5)第6分钟时,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,8分钟时达到平衡,N2的转化率__________(填“增大”、“减小”、“不变”)。
-
某温度时,在一容积为1L的密闭容器中,加入0.4 mol的N2和1.2 mol的H2,在一定条件下发生如下反应:N2(B)+3H2(g) 2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g) △H<0,5min 时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:

请回答下列问题:
(1) 根据如图,计算从反应开始到平衡时,平均反应速率v(N2)=_________。
(2) 该反应的化学平衡常数表达式为__________________。
(3) 反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填序号)。
A.0.80mol·L-1 B.0.25mol·L-1 C.0.20mol·L-1 D.0.08mol·L-1
(4) 反应达到平衡后,第5 min末保持其他条件不变,若只把容器的体积缩小一半,平衡移动_________(填“向右”、“向左”或“不”,化学平衡常数_________( 填“增大”、“减少”或“不变”)
-
(20分)在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:

(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_____。
(2)该反应的化学平衡常数表达式K = ____ _________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。








