-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2
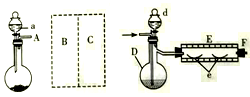
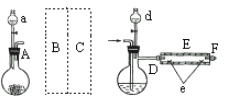
实验室用下图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管。e是两只耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入约120℃的D中,经过几小时的连续反应,在E管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)仪器D的名称是__。给D加热最好选择下列加热器中的__。

(2)若在A中烧瓶中盛固体CaCO3,a中盛6mol·L-1盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置所装的试剂是:B为_______,C为_______。为防止污染空气,实验时应在F处连接盛有__ 溶液的尾气吸收装置。
(3)实验时,装置D和E的橡胶管用铝箔包住,且连接D、E之间的橡胶管可能短的原因是______。
(4)①E管反应前先通入一段时间CO2,其主要作用是________;
②反应过程中要继续通入CO2,其主要作用是________。
II.探究FeBr2的还原性
某课外小组学生对Cl2与 FeBr2溶液反应进行实验探究。
| 操作 | 现象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
| 
| i. 开始通入100mLCl2(折合标班状况),溶液由浅绿色逐渐变黄; ii.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(5)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+、使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。
请设计实验证明现象i中溶液由浅绿色变黄色的原因是原因①还是原因②:___________。
(6)若向上述FeBr2溶液中通入168mLCl2(标准状况),则反应的离子方程式为___________。
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
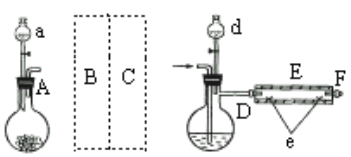
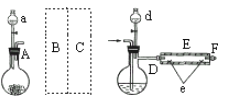
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
请回答:
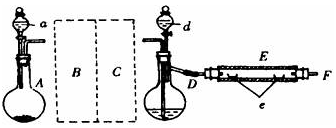
(1)若在A中盛固体CaCO3,a中盛6mol/L盐 酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试
酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试 剂应是:B为_____________,C为_____________.为防止污染空气,实验时应在F处连接盛_____________的尾气吸收装置
剂应是:B为_____________,C为_____________.为防止污染空气,实验时应在F处连接盛_____________的尾气吸收装置
(2)反应过程中要不断通入CO2,其主要作用是①__ __,②_____ .
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是_____________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的方法或操作
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明: ;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为: 。
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁

请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁

请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性_____________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是_____________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明: ;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为: 。
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
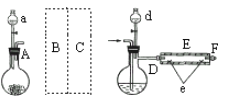
(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
-
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
-
(16分)FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/LFeBr2溶液
(1) 配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。

-
(17分)FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I:实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、玻璃棒、量筒、胶头滴管外还需的玻璃仪器是
(2)下列有关配制过程中说法正确的是 (填序号)。
a.用托盘天平称量质量为1.94g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏低
II:探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
请你完成下表,验证假设:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量CCl4,振荡、静置后 现象:__________________________; | 假设1正确 |
| ②向溶液中加入 溶液 现象: 。 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验主要操作名称是 ;
(2)实验证明:还原性Fe2+ > Br-
请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,则反应的离子方程式为: 。

酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试
剂应是:B为_____________,C为_____________.为防止污染空气,实验时应在F处连接盛_____________的尾气吸收装置









