-
(14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H = +67.7 kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________________。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为________酸(填“强”或“弱”), H2A的电离方程式为________,该溶液中由水电离出的c(H+)= ________。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a ________ b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a ________ b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a ________ b
高二化学填空题简单题查看答案及解析
-
火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知N2 (g) + 2O2 (g)=2NO2 (g) △H =+67.7 kJ/mol
N2H4 (g) +O2 (g)=N2 (g) + 2H2O (g) △H = -534 kJ/mol
则N2H4和NO2反应的热化学方程式为____________________________________________
高二化学填空题简单题查看答案及解析
-
火箭发射时可用肼( N2H4)作燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ/mol
则1 mol气体肼和NO2完全反应时放出的热量为 ( )
A. 100.3 kJ B. 567.85 kJ
C. 500.15 kJ D. 601.7 kJ
高二化学单选题中等难度题查看答案及解析
-
火箭发射时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成氮气和水蒸气。
已知:
N2 (g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
则1摩尔气体肼和NO2完全反应时放出的热量为
A. 100.3kJ B. 567.85kJ C. 500.15kJ D. 601.7kJ
高二化学单选题简单题查看答案及解析
-
发射“神六“时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C. N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 568.35kJ/mol
D. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
高二化学单选题中等难度题查看答案及解析
-
已知在发射卫星时可用肼(N2H4)为燃料、二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。又知:①N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
则肼与NO2反应的热化学方程式为
A.N2H4g)+NO2(g)=
N2(g)+2H2O(g)ΔH=+567.85kJ/mol
B.N2H4(g)+NO2(g)=
N2(g)+2H2O(g)ΔH=-567.85kJ/mol
C.N2H4(g)+NO2(g)=
N2(g)+2H2O(l)ΔH=+567.85kJ/mol
D.N2H4(g)+NO2(g)=
N2(g)+2H2O(l)ΔH=-567.85kJ/mol
高二化学选择题中等难度题查看答案及解析
-
(9分)发射卫星时可用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g) +2 O2(g) = 2NO2(g);△H=+67.7kJ·mol-1
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H=-534kJ·mol-1
1/2H2(g) + 1/2F2(g) = HF(g);△H=-269kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g);△H=-242kJ·mol-1
(1) 肼和二氧化氮反应的热化学方程式为________;此反应用于火箭推进,除释放大量能量和快速产生气体外,还有一个很大的优点是:__________________。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大。肼和氟气反应的热化学方程式为___。
高二化学填空题简单题查看答案及解析
-
(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:_______________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施): ___________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。
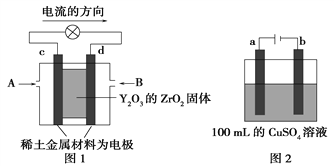
①c电极的名称为________,d电极上的电极反应式为__________________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为__________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=______(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_____(填序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
高二化学填空题困难题查看答案及解析
-
我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) +
N2O4(g) =
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
高二化学单选题简单题查看答案及解析
-
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1 ②N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-534kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是( )
A. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.7kJ·mol-1
B. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1000.3kJ·mol-1
C. N2H4(g)+NO2(g)=
N2(g)+2H2O(l) △H= -500.15kJ·mol-1
D. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ·mol-1
高二化学选择题中等难度题查看答案及解析