-
氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:
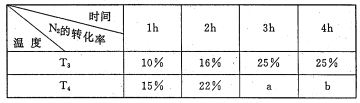
表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
-
非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式___。
,请写出此反应的热化学方程式___。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g) 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.35 | 0.35 |
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=__;1.00min~3.00min内,O2的平均反应速率为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
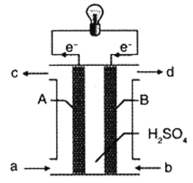
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析B极发生的电极反应式为__。
-
氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)2],请写出此反应的热化学方程式:___________。
(2)N2O5 在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量 N2O5,测得 N2O5 浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为 P0,第 2.00min 时体系压强为 P1,则 P1:P0=_________。2.00~5.00min 内用 NO2 表示的该反应的平均反应速率为_________。
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是________(填字母序号)。
a.NO2 和 O2 的浓度比保持不变 b.容器中压强不再变化
c.2v 正(NO2)=v 逆(N2O5) d.气体的平均相对分子质量为 43.2,且保持不变
(3)平衡常数 Kp 是用反应体系中气体物质的分压来表示的,即将K表达式中平衡浓度用平衡分压代替,分压=总压 × 物质的量分数,例如:p(NO2)=p总·x(NO2)(x表示气体的物质的量分数)。
N2O4 与 NO2 转换的热化学方程式为N2O4(g) 2NO2(g) △H=+24.4kJ/mol
2NO2(g) △H=+24.4kJ/mol
上述反应中,正反应速率 v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则 Kp 为_________(以 k 正、k 逆表示)。
(4)下图是密闭反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,合成 NH3 反应达到平衡时,混合物中 NH3 的物质的量分数随压强的变化曲线,已知该反应为放热反应。
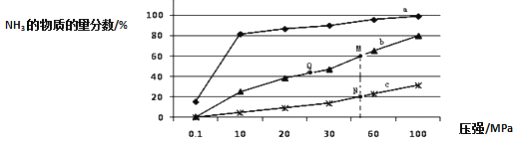
①曲线 a 对应的温度是________。
②M 点对应的 H2 的转化率是___________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。通过计算判定(NH4)2SO2 溶液的酸碱性________。(写出计算过程,并用简要的文字加以说明)(已知:氨水Kb=1.8×10-5;H2SO3:Ka1=1.3×10-2 Ka2=6.3×10-8)
-
I.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJ•mol-¹
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ•mol -¹
-¹
2C(s)+O 2(g)=2CO(g) △H=﹣221kJ•mol-¹
若某反应的平衡常数表达式为: ,请写出此反应的热化学方程式 。
,请写出此反应的热化学方程式 。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容 器中N2O5浓度随时间的变化如下表:
器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①2.00min~5.00 min内,NO2的平均反应速率为 ;已知气体的物质的量与体系压强成正比,若反应开始时体系压强为P0,第4.00 min时体系压强为P1,则P1∶ P0= ;
P0= ;
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的密度保持不变
II.双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2  O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
-
非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
⑴已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式_________________。
,请写出此反应的热化学方程式_________________。
(2)N2O5在一定条件下可发生分【解析】
2N2O5(g)  4NO2(g)+O2(g)。△H>0。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。△H>0。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
反应开始时体系压强为P0,第3.00min时达到平衡体系压强为p1,则p1:p0=_____________ ;1.00min~3.00min内,O2的平均反应速率为________________。从表中可知化学反应速率变化规律是___________________。
①该温度下反应的平衡常数Kp=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是_______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
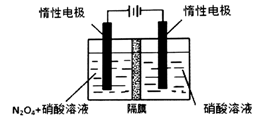
(3)从N2O5可通过电解或臭氧氧化N2O4的方法制备。电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为________________。
-
氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为: ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)  4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= _____________;2.00min~5.00 min内,O2的平均反应速率为 _______________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 ______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)  2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
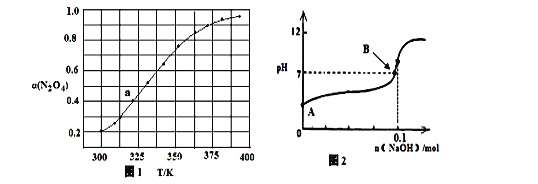
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量 ________mol(保留两位有效数字)。
-
氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为: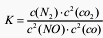 ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)  4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= _____________;2.00min~5.00 min内,O2的平均反应速率为 _______________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 ______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)  2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
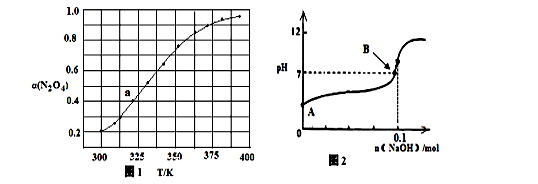
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量 ________mol(保留两位有效数字)。
-
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。
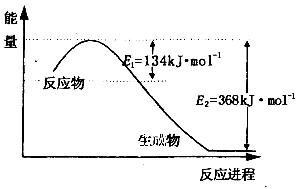
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
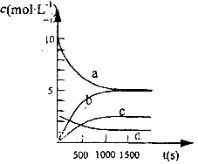
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
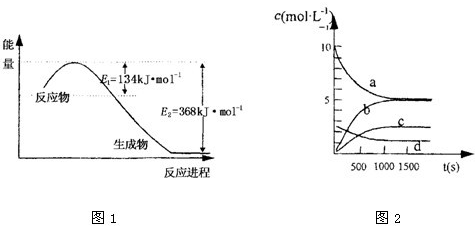
(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式______;
又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ•mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ•mol-1;则反应:2NO(g)+2CO2(g)⇌N2(g)+2CO2(g)的△H=______;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)⇌2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=______,已知:K300℃>K350℃,则该反应是______热反应
②反应达到平衡后,NO2的转化率为______,此时若再通入一定量氮气,则NO2的转化率将______(填“增大”、“减小”、“不变”);
③如图2中表示N2O5 的浓度的变化曲线是______,用O2表示从0~500s内该反应的平均速率v=______.
-
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
-¹
,请写出此反应的热化学方程式 。
器中N2O5浓度随时间的变化如下表:
P0= ;
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。






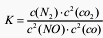 ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。



