-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
① CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) △H=-764.5kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-764.5kJ/mol
② CO(g)+ O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③ H2(g)+ O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
则CO(g)+2H2(g)=CH3OH(g) △H=__________kJ/mol
(2)下列措施中能够增大上述合成甲醇反应的速率的是_________(填写序号)。
a.使用高效催化剂
b.降低反应温度
c.增大体系压强
d.不断将CH3OH从反应混合物中分离出来
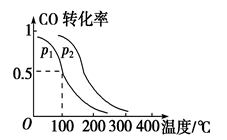
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示
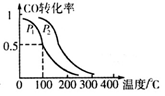 。
。
① P1_________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=_________(mol L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”、或“不变”)
(4)某科研小组用SO2为原料制取硫酸。
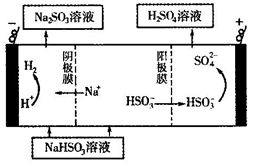
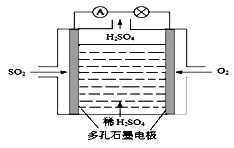
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式__________。
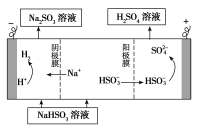
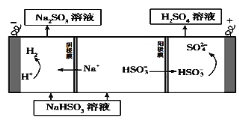
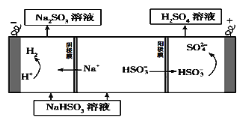
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如右图所示。请写出开始时阳极反应的电极反应式____________。

-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。

请写出开始时阳极反应的电极反应式________________。
-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
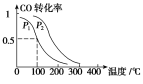
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
-
I:运用化学反应原理知识研究如何利用CO、SO2等污染物有非常重要的意义。
(1)用CO可以合成甲醇。
已知: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H1
CO(g)+1/2O2(g)=CO2(g) △H2
H2(g)+1/2O2(g)=H2O(l) △H3
请写出由CO和H2形成CH3OH的热化学方程式___________________________________________
(2)—定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:
CO(g) +2H2(g) CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
CH3OH(g) △H,CO转化率与温度、压强的关系如图所示:
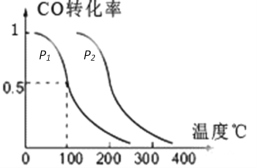
①下列说法正确的是__________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体平均相对分子质量恒定,反应达到平衡状态
C.若v(CO)=v(CH3OH)时,反应达到平衡状态
D.反应中,催化剂使平衡向正反应方向移动
②该反应的△H________0,p2_______________p1(填“大于”“小于”或“等于”)。
③100℃时,该反应的化学平衡常数K=__________.
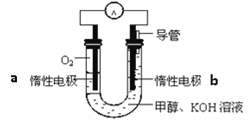
II:甲醇是一种燃料,也可以作为燃料电池的原料
(3)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置,则电池正极的电极反应式:______,该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为_______________________________________;
-
运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
CO(g)+ O2(g)=CO2(g)△H=-283.0kJ•mol-1;
O2(g)=CO2(g)△H=-283.0kJ•mol-1;
H2(g)+ O2(g)=H2O(l)△H=-285.8kJ•mol-1;
O2(g)=H2O(l)△H=-285.8kJ•mol-1;
则CO(g)+2H2(g) CH3OH(g)△H=___________kJ•mol-1.
CH3OH(g)△H=___________kJ•mol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
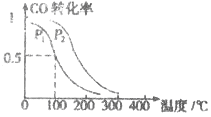
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。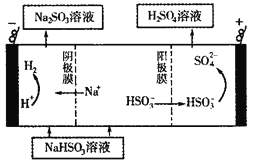
-
运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJ•mol-1;
CO(g)+ O2(g)=CO2(g)△H=-283.0kJ•mol-1;
O2(g)=CO2(g)△H=-283.0kJ•mol-1;
H2(g)+ O2(g)=H2O(l)△H=-285.8kJ•mol-1;
O2(g)=H2O(l)△H=-285.8kJ•mol-1;
则CO(g)+2H2(g) CH3OH(g)△H=___________kJ•mol-1.
CH3OH(g)△H=___________kJ•mol-1.
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___________(填写序号).
a.使用催化剂;b.降低反应温度;
c.增大体系压强;d.不断将CH3OH从反应混合物中分离出来;
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示.
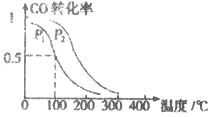
①P1___________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=___________;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、 H2、CH3OH各0.5amol,则平衡___________(填“向左”“不”或“想右”)移动
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___________;
(5)CaSO3溶液与CaC12溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________。用CaSO3溶液充分吸收SO2得NaHSO2溶液,然后电解该溶液,电解原理示意图如下图所示。请写出该电解池发生反应的化学方程式___________。
-
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。

-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。
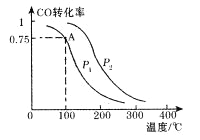
①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。
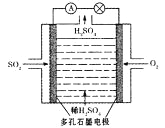
该电池中右侧为________极,写出该电池负极的电极反应式 ____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。
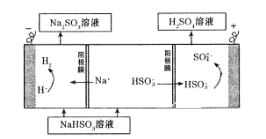
写出开始电解时阳极的电极反应式____________________
-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.
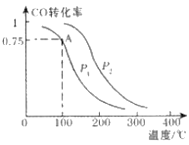
①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
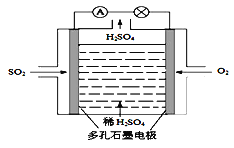
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。
(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.
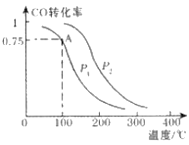
①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。
(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。


 。
。


















