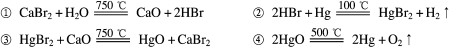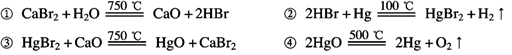-
(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ _____ + ________ ④2HgO
_____ + ________ ④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_________________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:__________________。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x=5.0 mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
①CaBr2+H2O CaO+2HBr;
CaO+2HBr;
②2HBr+Hg HgBr2+H2↑;
HgBr2+H2↑;
③HgBr2+CaO HgO+CaBr2;
HgO+CaBr2;
④2HgO 2Hg+O2↑.
2Hg+O2↑.
该方案的主要目的是为了制备( )
A.HBr
B.CaO
C.H2
D.Hg
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤: ( )
 ①CaBr2+H2O
①CaBr2+H2O  CaO+2HBr ②2HBr+Hg HgBr2+H2↑
CaO+2HBr ②2HBr+Hg HgBr2+H2↑
 ③HgBr2+CaO HgO+CaBr2 ④2HgO
③HgBr2+CaO HgO+CaBr2 ④2HgO  2Hg+O2↑
2Hg+O2↑
该方案的目的是为了制备
A.HBr B.CaO C.H2 D.Hg
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
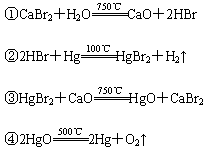
该方案的目的是制备( )
A.HBr B.CaO C.H2 D.Hg
-
溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr2•2H2O的实验流程如下:
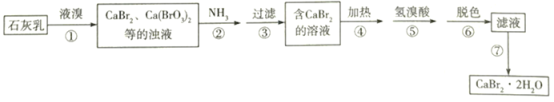
(1)步骤①需控制在70℃以下,温度不宜过高的原因是________________。
(2)下列实验室制取少量NH3的方法正确的是_____________(填标号)。
A. B.
B. C.
C. D.
D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为_______________________。
(4)步骤④、⑤的目的依次是_______________________________、________________________。
(5)步骤⑥常用_________________进行脱色,它利用了该物质的____________________。
(6)步骤⑦得到产品的操作方法是__________________________________________。
-
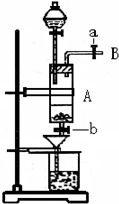
三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3•6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.填写下列空白:
(1)收集导管B处的气体可采用的方法是________.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是________.
(2)烧杯内放过量稀HNO3的原因是________.发生反应的离子方程式是________.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O,而不用直接蒸干的方法来制得晶体的理由是________
(5)你认为该实验存在的缺点可能有:________.
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
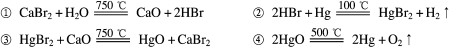
该方案的相关叙述正确的是
A.该实验的目的是制取HBr B.该过程的副产品是Hg
C.该过程得到的气体只有H2 D.该过程的本质是水的分解
-
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
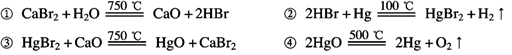
该方案的相关叙述正确的是
A.该实验的目的是制取HBr B.该过程的副产品是Hg
C.该过程得到的气体只有H2 D.该过程的本质是水的分解
-
“绿色化学”主要内容之一是指从技术和经济上设计可行的化学反应,使原子充分利用,不产生污染物。若以铜为原料制取硫酸铜或硝酸铜,下列设计符合“绿色化学”思想的方法是
A.制CuSO4:Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
B.制CuSO4:2Cu + O2 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
2CuO,CuO+H2SO4(稀)=CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
-
“氢能”是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出 热量,则氢气燃烧的热化学方程式为________
热量,则氢气燃烧的热化学方程式为________ 填序号
填序号 。
。
A.

B.

C.

D.

(2)某化学家根据“原子经济”的思想,设计了如下制备 的反应步骤:
的反应步骤:




请你根据“原子经济”的思想完成上述步骤 的化学方程式:__________。并根据“绿色化学”的思想评估该方法制
的化学方程式:__________。并根据“绿色化学”的思想评估该方法制 的主要缺点:_______。
的主要缺点:_______。
(3)利用核能分解水制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。
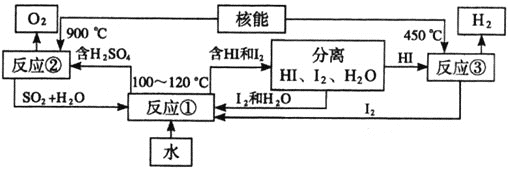
完成下列反应的化学方程式:
反应 :________________________________;
:________________________________;
反应 :________________________________。
:________________________________。
此法制取氢气的最大优点是________________________________。
CaO+2HBr ②2HBr+Hg
HgBr2+H2
_____ + ________ ④2HgO
2Hg+O2↑
CO2(g)+H2(g) △H<0

 B.
B. C.
C. D.
D.