-
某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
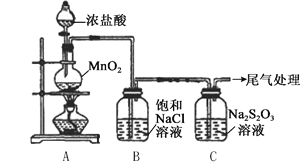
实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。
-
(15分)某小组用下图所示装置对Cl2与Na2S2O3的反应进行探究(气密性已检验)。

实验操作和现象:
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀。 |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a.S2O32—有较强的还原性
b.酸性条件下S2O32—迅速分解为S和SO2
(1)A中发生反应的离子方程式是 。
(2)B中饱和NaCl溶液的作用是 。
(3)C中生成黄色沉淀的离子方程式是 。
(4)为检验C中是否有SO2生成,需进行的操作是 。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是 。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是 。
-
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
-
甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
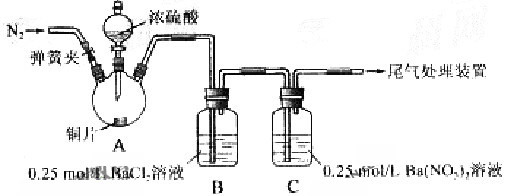
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | ___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:__________。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_______________。
-
甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色
与可溶性钡的强酸盐能否反应生成白色 沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验)
沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验)
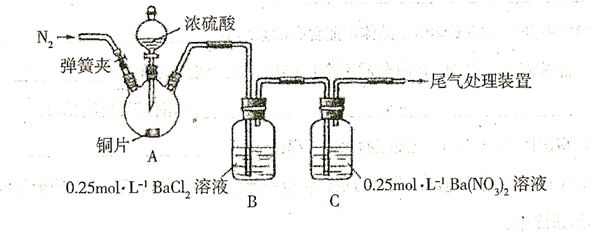
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A.中有白雾生成,铜片表面产生气泡 B.中有气泡冒出,产生大量白色沉淀 C.中产生白色沉淀,液面上方略显红棕色并逐渐消失 |
| 打开弹簧夹,通入 ,停止加热,一段时间后关闭 ,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是________。
(2)C中白色沉淀是________。
(3)C中液面上方生成红棕色气体的化学方程式是________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气中的氧气参与反应,乙同学认为是白雾(硫酸酸雾)参与反应。
①为证实各自的观点,在原实验基础上;甲同学在原有操作之前通 一段时间,目的是________。乙同学在A、B间增加盛有饱和
一段时间,目的是________。乙同学在A、B间增加盛有饱和 溶液的洗气瓶D,D中反应的离子方程式是________。
溶液的洗气瓶D,D中反应的离子方程式是________。
②各自进行实验,B中现象:
| 甲 | 大量不溶于稀盐酸的白色沉淀 |
| 乙 | 少量不溶于稀盐酸的白色沉淀 |
用离子方程式解释乙同学观察到的实验现象________
________(不必配平)。
(5)若将(4)中两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
-
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 |
| I | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
-
(15分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
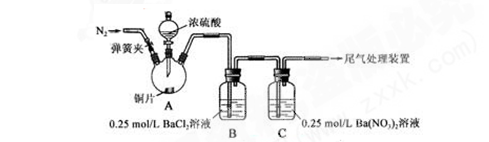
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | ___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________。
-
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。
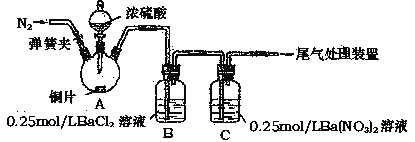
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | -------------------------------------------------- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是__________________________________________。
(2)C中白色沉淀是_________,该沉淀的生成表明SO2具有_________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上,甲同学在原有操作之前增加一步操作,该操作是_____________;乙同学在A、B间增加洗气瓶D,D中盛放的试剂是____________。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲:___________________,乙:__________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______________________。
-
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
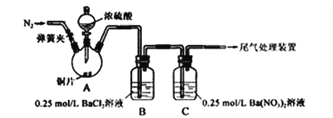
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________;
(2)C中生成白色沉淀的离子方程式为__________________;
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。为证实各自的观点,在原实验基础上,甲、乙两同学分别作了如下实验:甲在原有操作之前通N2,一段时间,B中产生大量白色沉淀。乙在A、B间增加盛放饱和NaHSO3溶液的洗气瓶,B中有少量白色沉淀。产生少量沉淀的原因是_____________。
(4)结合(3)中两同学的实验现象。你认为原实验B中产生大量白色沉淀的主要原因是_____________。
-
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
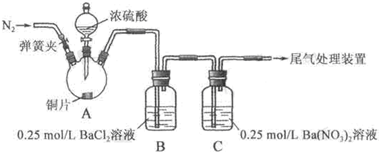
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是______ CuSO4+SO2↑+2H2O










