-
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)= 。
③不能作为判断该反应达到平衡状态的标志是 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
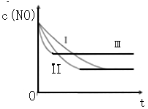
| 实验 编号 | T/oC | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K= 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为 。
-
(16分)汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H=﹣746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)⇌2CO(g)△H=﹣221.0KJ/mol
C (s)+O2(g)⇌CO2(g)△H=﹣393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ•mol﹣1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10﹣4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | | | | | |
| C(CO)10﹣3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | | | | | |
| | | | | | | | | | | | | |
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| | H2O | CO | CO | H2 | |
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
| | | | | | |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比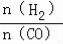 的变化曲线如图1所示。
的变化曲线如图1所示。
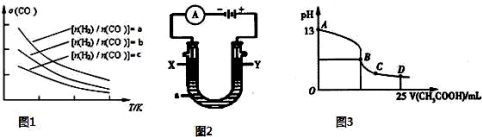
①a、b、c按从大到小的顺序排序为 。
②根据图象可以判断该反应为放热反应,理由是 。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2﹣。
①则负极的电极反应式为 。
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为 g。
-
(17分)汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO | H2 |
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
| | | | | | |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
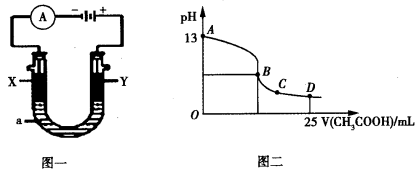
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
-
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定 量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10- 4 mol/L 4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
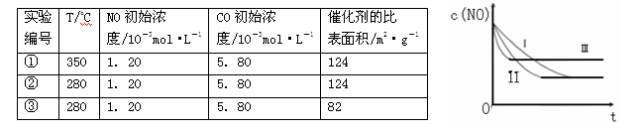
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
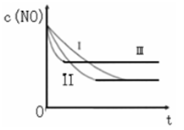
则曲线I对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min |
| H2O | CO | CO | H2 |
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
| | | | | | |
①实验组①中以v(CO2)表示的反应速率为 。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为:α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为______________ __。
__。
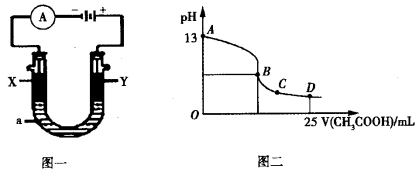
② 以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电
以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电 解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
-
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则 N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
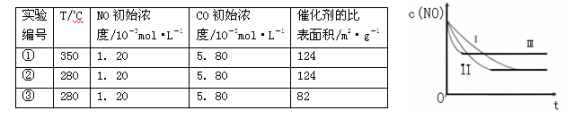
则曲线II对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO | H2 |
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
| | | | | | |
①实验组i中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O) αiii (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
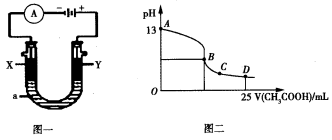
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
-
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则 N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
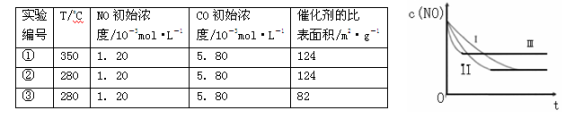
则曲线II对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO | H2 |
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
| | | | | | |
①实验组i中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O) αiii (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
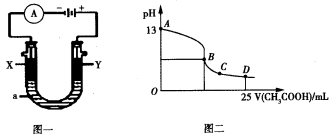
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
-
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1 )2NO(g)+2CO(g)
)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1
C(s)+O2(g) CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1
则N2(g)+O2(g)=2NO(g) △H = kJ•mol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO | H2 |
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
| | | | | | |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比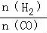 的变化曲线如图1所示。
的变化曲线如图1所示。
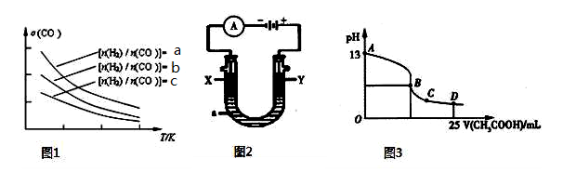
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池 ,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
-
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g) 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g) CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g)═2NO(g) △H= ____________ kJ/mol
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2较合理的数值为_________(填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g)  CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | CO | H2 |
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | C | d | 1 |
若a=2,b=1,则c=____,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比 的变化如图所示:
的变化如图所示:
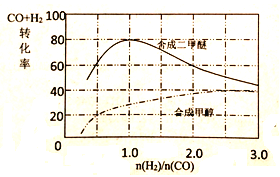
①合成二甲醚的最佳氢碳比为__________。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为________________。
-
汽车尾气中的主要污染物是NO、NO2和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
[研究一]用NaOH溶液吸收NO、NO2,
⑴当n(NO)﹕n(NO2)=1时只生成一种盐,这种盐的化学式为__________
⑵当只有NO2时,生成两种盐:2NO2+2NaOH=NaNO2+NaNO3+H2O。若NaOH溶液恰好完全吸收NO2后溶液显碱性,该溶液中离子浓度由大到小的顺序是:___________。
[研究二]一定条件将CO和NO转化为无污染产物:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
⑶已知:2C(s)+O2(g)=2CO(g);△H1=-221.0KJ/mol
C(s)+O2(g)=CO2(g);△H2=-393.5KJ/mol
N2(g)+O2(g)=2NO(g);△H3=+180.5KJ/mol。
则△H=______
⑷T℃下,在固定容积的密闭容器中,通入一定量NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) 10−4 mol/L | 10.0 | 4.50 | 2.00 | 1.50 | 1.00 | 1.00 |
| c(CO) 10−3 mol/L | 3.60 | 3.05 | 2.80 | 2.75 | 2.70 | 2.70 |
①该条件下,2s内N2的平均反应速率v(N2)=_____________
②若往容器中加入一定量生石灰,CO平衡转化率_____(选填“增大”、“减小”或“不变”)
③其它条件不变,只适当升高温度,则4s时,c(NO)=c1mol/L,则c1可能是_______
a.1.10×10﹣3 b.1.25×10﹣4 c.1.00×10﹣4 d.9.00×10﹣5
【研究三】测定汽车尾气中CO的含量
⑸用CO分析仪测定:该分析仪的工作原理类似于燃料电池,其中电解质是能传导O2﹣的Y2O3和ZrO2晶体,负极的电极反应式为____________。
⑹用五氧化二碘(I2O5)固体氧化定量检测:I2O5+5CO=I2+5CO2
抽取10L汽车尾气,用足量I2O5吸收,然后配成100mL溶液,量取其中的20.00mL溶液,用0.0050mol/LNa2S2O3溶液滴定,三次平行实验平均消耗Na2S2O3溶液的体积为20.00mL,已知:2Na2S2O3+I2=Na2S4O6+2NaI,则尾气中c(CO)=___________
-
运用化学反应原理知识回答下列有关碳和碳的化合物的问題
⑴汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(己知该反应在一定条件下可以自发进行)。在2L密闭容器中加入一定量NO和CO,当溫度分别在T1和T2时,测得各物质平衡时物质的量如下表:
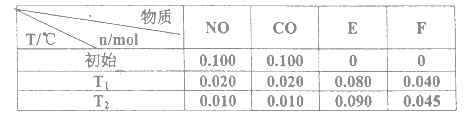
①请结合上表数据,写出NO与CO反应的化学方程式___________________,该反应的△S_______0 (填“<”或“>”)。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。根据表中数据计算K1=_________,根据表中数据判断,温度T1和T2关系是(填序号)______________。
A. T1>T2 B. T1<T2 C.无法比较
(2)生成的CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200mL3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为____________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3
溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为:___________mol/L。(忽略混合前后溶液体积的变化)
(4)己知14gCO完全燃烧时放出141.5 kJ 的热量,则写出CO燃烧热的热化学方程式:_____________。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用
Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极:_________;正极:________

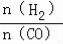 的变化曲线如图1所示。
的变化曲线如图1所示。








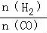 的变化曲线如图1所示。
的变化曲线如图1所示。

