-
钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是 .试写出制备金属钠的化学方程式 .金属钠可用于 (写出Na在熔点低方面的一种用途).
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:

①正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 .
②请写出检验Na2CO3中钠元素的方法 .
(3)常温下,浓度均为0.1mol•L﹣1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | 6 | 0.3 | |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01mol•L﹣1的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L﹣1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 .
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”).
-
(14分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是____________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为___________,电池工作时物质A可循环使用,A物质的化学式为_____________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
-
【化学一选修3:物质结构与性质】
铜也是日常生活中常见的金属,它的单质及化合物在科学研究和工农业生产中具有广泛的用途。请回答以下问題:
(1)超细铜粉可用作导电材料、傕化剂等,制备方法如下:
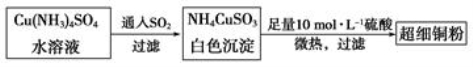
写出基态Cu的外围电子排布式________________,铜元素位于周期表中笫______________族;NH4CuSO3所含元素中第一电离能最大是____________(填元素符号)。
SO42-中心原子的杂化方式为___________,SO32-的空间构型为__________。
③ 将NH4CuSO3溶于足量稀硫酸中,有剌激性气味的气体放出,该气体是__________,所得溶液呈__________色。
(2)某学生向CuSO4浓液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到 深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4 • H2O晶体。
①下列说法正确的是_______(填代号)
A.氨气极易溶于水,是因为NH3和H2O之间形成了极性共价键
B.NH3和H2O中心原子的杂化方式相同,键角也相同
c.Cu(NH3)4SO4所含的化学键有离子键、极性键和配位键
d.[Cu(NH3)4]SO4中配离子的空间构型为正方形
②请解释加入乙醇后析出晶体的原因________________。
(3)Cu晶体的堆积方式如右图所示,设Cu原子半径为a,晶体中Cu原子的配位数为______________,晶体的空间利用率为________________。(已知: ,列式并计算出结果)
,列式并计算出结果)

-
(12分)
钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是________。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含________;
假设2:该漂白粉全部变质,只含________;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 |
| ① | 取少量上述漂白粉于试管中,________ ________ | ________ |
| ② | | |
| ③ | | |
-
钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式________。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是________。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含________;
假设2:该漂白粉全部变质,只含________;
假设3:该漂白粉部分变质,________。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 |
| ① | 取少量上述漂白粉于试管中,________ ________ | ________ |
| ② | | |
| ③ | | |
-
(16分)
钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式________。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是________。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。①提出合理假设。
假设1:该漂白粉未变质,只含________;
假设2:该漂白粉全部变质,只含________;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 |
| ① | 取少量上述漂白粉于试管中,________ ________ | ________ |
| ② | | |
| ③ | | |
-
锰及其化合物用途广泛,工业上可用作脱硫剂、催化剂。
(1)工业上由二氧化锰通过铝热反应制备锰,写出反应的化学方程式__________________。
(2)制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和 铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
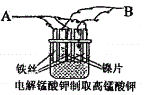
①A应与直流电源的_______极相连接,铁丝电极的电极反应式为___________________________。
②电解的总反应的离子方程式为________________________________,电解一段时间后,溶液的pH________________。(“升高”“降低”“不变”)
-
【化学—选修3:物质结构与性质】
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①铜元素位于周期表_________区;Cu+的基态价电子排布图_________;NH4CuSO3中N、S、O三种元素的第一电离能由大到小的顺序为_________(元素符号表示)。
②SO42-中心原子的杂化方式为_________,SO32-的价层电子互斥模型为_________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式_________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是_________。
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_________。
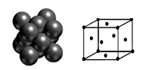
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为_________,用含有a、ρ的代数式表示的阿伏加德罗常数为:_________ mol-1。
-
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
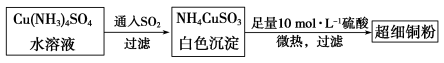
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
② 的空间构型为_____________,
的空间构型为_____________, 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 (  ,列式并计算结果)。
,列式并计算结果)。

-
高铁酸盐在能源、环保等方面有着广泛的用途。工业上制备K2FeO4的常用方法有两种。
方法一:湿法。工艺流程如图1。

(1)完成“氧化”过程中反应的化学方程式:
_____FeCl3+_____NaOH+_____NaClO═______Na2FeO4+_________+___________,
其中氧化剂是__________(填化学式)。
(2)加入饱和KOH溶液的目的是__________;用异丙醇洗涤的目的是__________。
方法二:干法。把Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物。
(3)在干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为__________。









