-
【化学—选修3:物质结构与性质】
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①铜元素位于周期表_________区;Cu+的基态价电子排布图_________;NH4CuSO3中N、S、O三种元素的第一电离能由大到小的顺序为_________(元素符号表示)。
②SO42-中心原子的杂化方式为_________,SO32-的价层电子互斥模型为_________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式_________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是_________。
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_________。
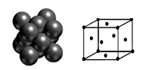
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为_________,用含有a、ρ的代数式表示的阿伏加德罗常数为:_________ mol-1。
-
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
② 的空间构型为_____________,
的空间构型为_____________, 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 (  ,列式并计算结果)。
,列式并计算结果)。

-
【化学一选修3:物质结构与性质】
铜也是日常生活中常见的金属,它的单质及化合物在科学研究和工农业生产中具有广泛的用途。请回答以下问題:
(1)超细铜粉可用作导电材料、傕化剂等,制备方法如下:
写出基态Cu的外围电子排布式________________,铜元素位于周期表中笫______________族;NH4CuSO3所含元素中第一电离能最大是____________(填元素符号)。
SO42-中心原子的杂化方式为___________,SO32-的空间构型为__________。
③ 将NH4CuSO3溶于足量稀硫酸中,有剌激性气味的气体放出,该气体是__________,所得溶液呈__________色。
(2)某学生向CuSO4浓液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到 深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4 • H2O晶体。
①下列说法正确的是_______(填代号)
A.氨气极易溶于水,是因为NH3和H2O之间形成了极性共价键
B.NH3和H2O中心原子的杂化方式相同,键角也相同
c.Cu(NH3)4SO4所含的化学键有离子键、极性键和配位键
d.[Cu(NH3)4]SO4中配离子的空间构型为正方形
②请解释加入乙醇后析出晶体的原因________________。
(3)Cu晶体的堆积方式如右图所示,设Cu原子半径为a,晶体中Cu原子的配位数为______________,晶体的空间利用率为________________。(已知: ,列式并计算出结果)
,列式并计算出结果)

-
(15分)【选修3--物质结构与性质)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途.
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
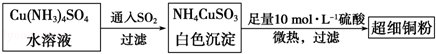
①Cu2+的价电子排布图 ;
NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为 (填元素符号).
②SO42﹣的空间构型为 ,SO32﹣离子中心原子的杂化方式为 .
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O晶体.
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
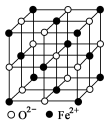
(4)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为________,若该晶胞边长为acm,则该晶体密度为 。
-
【化学-选修3 物质结构与性质】
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______ 。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
(3)k3[Fe(CN)6]溶液可用于检验 (填离子符号)。CN-中碳原子杂化轨道类型为 ,C、N、O三元素的第一电离能由大到小的顺序为 (用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如图所示。

①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数为NA,
则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
-
【化学——选修3 物质结构与性质】
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置为_________________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)=Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有_______________、_____________。
(3)K3[Fe(CN)6]溶液可用于检验___________(填离子符号)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能由大到小的顺序为__________(用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如右图所示。

①基态铜原子的核外电子排布式为____________________。
②每个铜原子周围距离最近的铜原子数目___________________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。
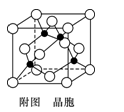
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子与M原子之间的最短距离为_______________pm(只写计算式)。
-
【化学—选修3:物质与结构】(15 分)铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁的核外电子排布式为 。
(2)配合物Fe(CO)x 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x 晶体属于______(填晶体类型)。Fe(CO)x 的中心原子价电子数与配体提供电子数之和为18,则x=______。
(3)K3[Fe(CN)6]的配体CN-中碳原子杂化轨道类型为______,C、N、O 三元素的电负性由大到小的顺序为______(用元素符号表示)。
(4)铜晶体铜原子的堆积方式如右图所示。


①铜位于元素周期表的 区。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M 原子的外围电子排布式为3s23p5,铜与M 形成化合物的晶胞如附图所示(黑点代表铜原子)。该晶体中铜原子和M 原子之间的最短距离为a pm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3 (只写计算式)。
-
(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
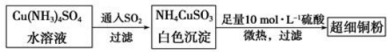
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

-
【化学一一选修3:物质结构与性质】过渡金属元素的单质及化合物在科学研究和工业生产中具有许多用途,根据所学知识回答下列问题:
(1)基态Ni2+的核外电子排布式_______________;配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,固态Ni(CO)4,属于_______________晶体;镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的价电子排布为3d10,则其杂化轨道类型为_______________,Ni(CO)4是_______________(填“极性”或“非极性” )分子。
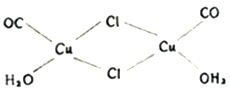
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为_______________;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含_______________个配位键。
(3)铜能与类卤素(SCN)2 反应生成 Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为__________; 类卤素 (SCN)2 对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______________。
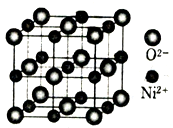
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为_______________g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。
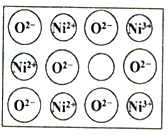
人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为_______________。
-
【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1〜d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示
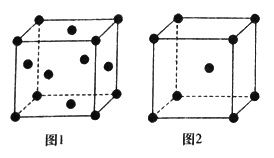
①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
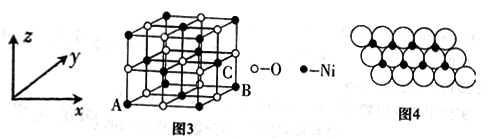
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)