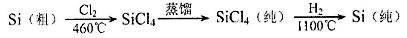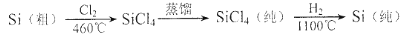-
(本题10分)
元素的单质及其化合物有着广泛的用途。请根据元素周期表中第三周期元素相关知识回答下列问题。
完成下列填空:
23.按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
A.原子半径和简单离子半径均减小
B.金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
24.原子最外层电子数与次外层中p亚层电子数相同的元素名称是__________,磷元素原子最外层电子排布的轨道表示式是________________________________。
25.已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________________________。
26.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________________。
27.KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: _______________
-
(15分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)氧化性最弱的简单阳离子的结构示意图是 。
(3)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式 。
(4)Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
(5)已知:2SO2(g)+O2(g) 2SO3(g) 平衡常数为K1
2SO3(g) 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) 平衡常数为K2
2NO2(g) 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)
SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO2和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式 。
-
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时的反应方程式是 ;制铝时,电解Al2O3不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
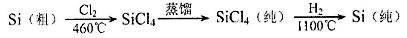
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的:
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
-
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:____。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:____。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______________。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________,氧化性最弱的简单阳离子是___。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________________________;制铝时,电解Al2O3而不电解AlCl3的原因是_________________________________________。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
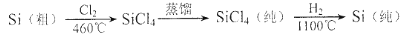
写出SiCl4的电子式:____________;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_______。
a. NH3b. HI c. SO2d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________。
-
Ⅰ.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素知识回答问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素为__________(填名称);氧化性最弱的简单阳离子是________________(填离子符号)。
(3)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_________(填字母)。
a.NH3 b.HI c.SO2 d.CO2
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________。
Ⅱ.氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙,甲和乙是二元化合物。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物, 该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(5)甲的化学式是___________________;乙的电子式是___________。
(6)甲与水反应的化学方程式是______________________。
(7)判断:甲与乙之间____________(填“可能”或“不可能”)发生反应产生H2。
-
(本题共12分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
23、第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是 ;氧化性最强的阳离子是 。
24、下列事实可以作为S和Cl非金属性强弱的判断依据的是 (选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S
25、硅元素最外层有 种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式: 。
26、PH3和NH3的某些化学性质相似。下列对晶体PH4I性质的推测,错误的是 (选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应
27、二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是 (选填序号)
a.S 2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价
d.S2C12分子中各原子均为8电子稳定结构
28、已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO3- H++SO32- ②
H++SO32- ②
向0.1mol/L的NaHSO3溶液中加入少量氢氧化钠固体,则 (填“增
(填“增
大”“减小”或“不变”,后同), 。
。
2SO3(g) 平衡常数为K1
2NO2(g) 平衡常数为K2
SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)