-
雌黄 As2S3 和雄黄 As4S4 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有 抗病毒疗效也用来入药。
(1)砷元素有+2、+3 两种常见价态。雄黄在空气中加热至 300℃时会生成两种氧化物,其 中一种氧化物为剧毒的砒霜(As2O3),则物质 a 是_____,可用双氧水将 As2O3 氧化为 H3AsO4,写出该反应的化学方程式:________。
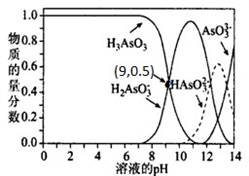
(2)亚砷酸 H3AsO3 可以用于治疗白血病,其在溶液中 存在多种微粒形态,25℃时,各种微粒物质的量分数与 溶液的 pH 关系如图所示。
①人体血液的 pH 在 7.35 ~7.45 之间,用药后人体中 含砷元素的主要微粒是_____。
②下列说法不正确的是_____(填字母序号)。
A.n(H3AsO3):n(H2AsO3-)=1:1 时,溶液显碱性
B.25℃时,H3AsO3 的第一电离平衡常数的值 Ka1=10-5
C.在 K3AsO3 溶液中, c(AsO33-)>c(HAsO32-)>c(H2AsO3-)
③将 KOH 溶液滴人亚砷酸溶液,当 pH 调至 11 时发生反应的离子方程式 是_____。
(3)P 和 As 属于同主族元素,存在亚磷酸(H3PO3),该酸与足量的 NaOH 溶液反应生成Na2HPO3。工业电解 Na2HPO3 溶液可得到亚磷酸,装置示意图如下:
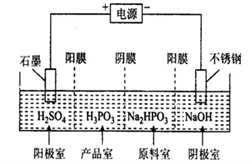
①产品室中反应的离子方程式为_____;
②得到 1mol 亚磷酸的同时,阴极室制得 NaOH 质量为_____g。
-
(6分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________。
(2)上述反应中的还原剂是________,反应产生的气体可用________吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
-
《日华子本草》中已有关于雄黄的记载“雄黄,通赤亮者为上,验之可以虫死者为真。”雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。 回答下列问题:
(1)基态砷原子的价电子轨道排布图为_______,核外电子占据的最高能级的电子云轮廓图形状为_______。
(2) S、P和N三种元素第一电离能由大到小的顺序是_______。
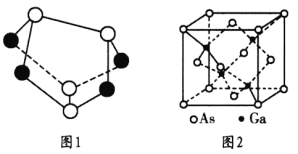
(3) 雄黄(As4S4)的结构如图1所示,S原子的杂化形式为_______。
(4) SO2分子中的 键数为______个,分子的空间构型为_______。分子中的大
键数为______个,分子的空间构型为_______。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则SO2中的大
),则SO2中的大 键应表示为______。SO2分子中S—O键的键角_____NO3-中N—O键的键角(填“> ”、“<”、“=”)。
键应表示为______。SO2分子中S—O键的键角_____NO3-中N—O键的键角(填“> ”、“<”、“=”)。
(5)砷化镓是优良的半导体材料,密度为  g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则砷化镓晶体的空间利用率为________。
g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则砷化镓晶体的空间利用率为________。
-
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______.
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为______.若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量______(选填编号).
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
-
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H++ 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
-
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
-
铜单质及其化合物在很多领域有重要的用途.
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
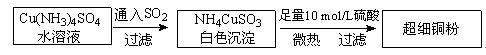
(1)超细铜粉的某制备方法如下:

 中的配体是_______________________ 。
中的配体是_______________________ 。
(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________________ 。
溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________________ 。
(二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.
(1)与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 _______________________  填元素符号
填元素符号 。
。
(2)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体是____________________(写化学式),实验中所加
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体是____________________(写化学式),实验中所加 的作用是________________________。
的作用是________________________。
(3) 晶体中呈正四面体的原子团是______ ,杂化轨道类型是
晶体中呈正四面体的原子团是______ ,杂化轨道类型是 杂化的原子是____________。
杂化的原子是____________。
-
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中所含的化学键有________、________、________,
N、O、S三种元素的第一电离能大小顺序为:________>________>________。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为:________。
③ NH3分子中N原子的杂化方式为:________。
④与SO2互为等电子体的分子有________(写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通人一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
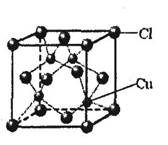
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________。
②CuCl的熔点比CuO的熔点________。(填“高”或“低”)
-
化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
A.“地沟油”经过加工处理后,可以用来制肥皂
B.二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白
C.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
D.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中
-
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s) Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
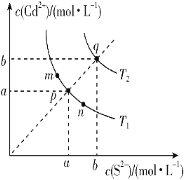
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动






