-
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验
编号
T/K
催化剂的用量 / g
酸性KMnO4溶液的浓度/mol•L-1
实验目的
①
298
0.5
0.010
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响;
b.实验①和③探究
对反应速率的影响
c. 实验①和④探究催化剂对反应速率的影响。
②
298
0.5
0.001
③
323
0.5
0.010
④
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号
溶液褪色所需时间 t / min
第1次
第2次[
第3次
①
12.8
13.0
11.0
②
4.9
5.1
5.0
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
高三化学实验题困难题查看答案及解析
-
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):实验编号 T/K 催化剂的用量/g KMnO4酸性溶液的浓度/mol•L-1 实验目的 ① 298 0.5 0.01 (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和______探究温度对该反应速率的影响;
(Ⅲ)实验①和______探究催化剂对该反应速率的影响;)② ______ ______ ______ ③ ______ ______ ______ ④ ______ ______ ______
计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率______(忽略混合前后溶液的体积变化,写出计算过程).KMnO4酸性溶液
的浓度/mol•L-1溶液褪色所需时间 t/min 第1次 第2次 第3次 0.01 14 13 11 0.001 6 7 7
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?______.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:______.高三化学解答题中等难度题查看答案及解析
-
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):实验编号 T/K 催化剂的用量/g KMnO4酸性溶液的浓度/mol•L-1 实验目的 ① 298 0.5 0.01 (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和______探究温度对该反应速率的影响;
(Ⅲ)实验①和______探究催化剂对该反应速率的影响;)② ______ ______ ______ ③ ______ ______ ______ ④ ______ ______ ______
计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率______(忽略混合前后溶液的体积变化,写出计算过程).KMnO4酸性溶液
的浓度/mol•L-1溶液褪色所需时间 t/min 第1次 第2次 第3次 0.01 14 13 11 0.001 6 7 7
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?______.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:______.高三化学解答题中等难度题查看答案及解析
-
酸性 KMnO4 溶液能与草酸(H2C2O4)溶液反应。某化学探究小组利用反应过程中溶液紫色消失快慢的 方法来研究影响反应速率的因素。
I.实验前首先用浓度为 0.1000 mol/L 酸性 KMnO4 标准溶液滴定未知浓度的草酸溶液。
(1)写出滴定过程中发生反应的离子方程式 。
(2)下列有关一定物质的量浓度溶液配制的说法中正确的是 。
A.把 15.8 g KMnO4 固体溶于 1 L 水中所得溶液物质的量浓度为 0.1 mol/L
B.把 0.01 mol KMnO4 固体投入 100 mL 容量瓶中加水至刻度线,充分振荡后,浓度为 0.1 mol/L
C.需要 90 mL 0.1 mol/L 的 KMnO4 溶液,应准确称量 KMnO4 固体 1 58 g
D.定容时仰视容量瓶颈刻度线读数,会使配制的溶液浓度偏高
II.通过滴定实验得到草酸溶液的浓度为 0.2000 mol/L。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为 8.00 mL)。
实验编号
温度(℃)
催化剂用量(g)
酸性高锰酸钾 溶液
体积(mL)
浓度(mol/L)
1
25
0.5
4.00
0.1000
2
50
0.5
4.00
0.1000
3
25
0.5
4.00
0.0100
4
25
0
4.00
0.1000
(3)写出表中实验 1 和实验 2 的实验目的: 。
(4)该小组同学对实验 1 和实验 3 分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验
编号
溶液褪色所需时间 (min)
第 1 次
第 2 次
第 3 次
1
14.0
13.0
11.0
2
6.5
6.7
6.8
分析上述数据后得出“其他条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,甲同学改进了实验方案,请简述甲同学改进 的实验方案______________。
(5)该实验中使用的催化剂应选择 MnSO4 并非 MnCl2,原因可用离子方程式表示为________。
III.工业上可用软锰矿(主要成分为 MnO2)经下列生产过程制备高锰酸钾。
①由软锰矿提取得到 MnO2,然后在 MnO2、KOH 的熔融混合物中通入空气可制得锰酸钾(K2MnO4);
②向锰酸钾溶液中通入CO2可获得高锰酸钾。
(6)第①步生产过程中,在熔融混合物中通入空气时发生反应的化学方程式:______________。
(7)向锰酸钾溶液中通入CO2可获得高锰酸钾,该反应中氧化产物与还原产物的物质的量之比为________________。
高三化学填空题中等难度题查看答案及解析
-
(14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 。
(2)滴定过程中操作滴定管的图示正确的是 ________________________________________________________ 。


(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 ________________________________________________________________________(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。

(4)写出表中a 对应的实验目的 ________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为 ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
高三化学填空题中等难度题查看答案及解析
-
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。

(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号
温 度(℃)
催化剂用量(g)
酸性高锰酸钾溶液
实验目的
a.实验1和2探究
b.实验1 和3 探究反应物浓度对该反应速率的影响;
c.实验1 和4 探究催化剂对该反应速率的影响。
体积(mL)
浓度(mol•L-1)
1
25
0.5
4
0.1000
2
50
0.5
4
0.1000
3
25
0.5
4
0.0100
4
25
0
4
0.1000
(4)写出表中a 对应的实验目的 ;
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号
溶液褪色所需时间(min)
第1次
第2 次
第3 次
1
14.0
13.0
11.0
3
6.5
6.7
6.8
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示) 为 。
高三化学实验题极难题查看答案及解析
-
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
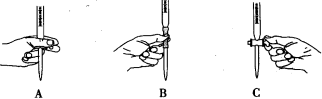
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号
温度(℃)
催化剂
用量(g)
酸性高锰酸钾溶液
实验目的
a. 实验1和2探究 ;
b. 实验1和3探究反应物浓度对该反应速率的影响;
c. 实验1和4探究催化剂对该反应速率的影响。
体积
(mL)
浓度
(mol•L-1)
1
25
0.5
4
0.1000
2
50
0.5
4
0.1000
3
25
0.5
4
0.0100
4
25
0
4
0.1000
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号
溶液褪色所需时间(min)
第1次
第2次
第3次
1
14.0
13.0
11.0
3
6.5
6.7
6.8
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案 。
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为 。
高三化学实验题中等难度题查看答案及解析
-
某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响.
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.1mol•L-1,H2C2O4溶液的浓度可选择0.1mol•L-1、0.2mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)实验设计:请完成以下实验设计表.
(2)实验准备:配制上述溶液需要用到的玻璃仪器有________.实验编号 T/K KMnO4浓度
/mol•L-1H2C2O4浓度
/mol•L-1实验目的 ① 298 0.01mol•L-1 0.1mol•L-1 为以下实验做对照 ② ________ ________ ________ ________ ③ ________ ________ ________ 探究浓度对反应速率的影响
(3)实验过程:实验时控制温度为323K的方法是________.
(4)实验记录:实验中需要记录的数据是________.高三化学填空题中等难度题查看答案及解析
-
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)______.
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成______个实验进行对比即可得出结论.
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
①计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程).KMnO4酸性溶液
的浓度/mol•L-1溶液褪色所需时间 t/min 第1次 第2次 第3次 0.01 14 13 11 0.001 6 7 7
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?______.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:______.高三化学解答题中等难度题查看答案及解析
-
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
20 mL 0.1 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
②
20 mL 0.2 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
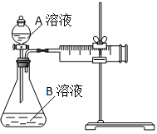
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
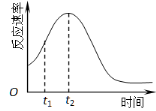 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是: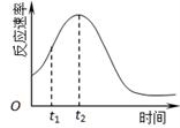
① ;② 。
高三化学填空题困难题查看答案及解析