-
Ⅰ 在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片[ | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式: ,
该反应是 反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花 s。
(3)对比结果B与F,解释结果F那么快的原因:
Ⅱ 某可逆反应在某体积为5 L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
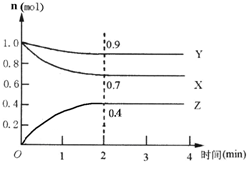
(1)该反应的的化学方程式为 ;
(2)反应开始至2分钟时,X的平均反应速率为 ;
(3)能说明该反应已达到平衡状态的是 ;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由右图求得平衡时Y的转化率为 。
-
Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:_________
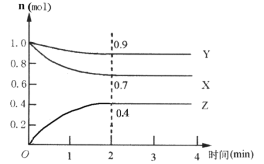
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
-
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温 度的曲线图(纵轴表示时间,横轴表示温度)。
度的曲线图(纵轴表示时间,横轴表示温度)。
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。
-
某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
| 实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
| ① | 铝粉 | 20 | 21 |
| ② | 铝片 | 20 | 82 |
| ③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
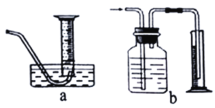
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。
-
(7分)在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于溶液的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
-
(8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(1)该实验的目的是研究________ 、________对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是________ 和 ________ 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 ________ 。
-
用相同质量的锌片和锌粉跟相同浓度的足量的稀盐酸反应,得到的实验数据如下所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/秒 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(1)实验①和②表明_______________________________,化学反应速率越大。
(2)能表明固体的表面积对反应速率有影响的实验编号是________和_________。
(3)该实验的目的是探究________、_________等因素对锌跟稀盐酸反应速率的影响。
(4)请设计一个实验方案证明盐酸的浓度对该反应速率的影响:_______________________________。
-
我校化学兴趣小组的小王同学用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 薄片 | 15 | 180 |
| ② | 薄片 | 25 | 70 |
| ③ | 粉末 | 25 | 15 |
(1)该实验的目的是探究__对锌和稀盐酸反应速率的影响;
(2)实验①和②表明__,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是__和__;
(4)请你设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_。
-
某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
| 实验编号 | 盐酸浓度/(mol/L) | 铁的形态 | 温度/K |
| 1 | 4.00 | 块状 | 293 |
| 2 | 4.00 | 粉末 | 293 |
| 3 | 2.00 | 块状 | 293 |
| 4 | 2.00 | 粉末 | 313 |
(1)若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是______。
(2)实验___和_____(填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究_______对该反应速率的影响。
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是______、______。
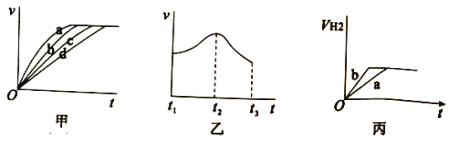
(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
①其中t1~t2速率变化的主要原因是______。
②t2~t3速率变化的主要原因是___________ 。
(5)实验1产生氢气的体积如丙中的曲线a,添加某试剂能使曲线a变为曲线b的是______。
A.CuO粉末 B.NaNO3固体 C.NaCl溶液 D.浓H2SO4
-
某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素。
该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究 、 对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明 ,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是 和 ,实验结论是 ;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:
。




