-
高锰酸钾在不同的条件下发生的反应如下:
MnO4—+5e-+8H+===Mn2++4H2O ①
MnO4—+3e-+2H2O===MnO2↓+4OH- ②
MnO4—+e-===MnO42—(溶液绿色) ③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 → 。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________(填字母)。
A.氧化性:PbO2>KMnO4
B.Mn2+被还原成MnO4—
C.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2。完成下列化学方程式:
①________KMnO4+________K2S+________===________K2MnO4+________K2SO4+________S↓+________。
②若生成6.4 g单质硫,反应过程中转移电子的物质的量为________。
高二化学填空题简单题查看答案及解析
-
高锰酸钾在不同的条件下发生的反应如下:
① MnO4-+5e-+8H+=Mn2++4H2O ②MnO4-+3e-+2H2O=MnO2↓+4OH-
(1)从上述两个反应中可以看出高锰酸根离子被还原的产物受溶液的 影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 → .
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法不正确的是 。
A.氧化性,PbO2>KMnO4 B.还原性:PbO2>KMnO4 C.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比 为3 : 2,完成下列化学方程式(横线上填系数,括号内填物质):
① KMnO4+ K2S+ ( ) = K2MnO4 + K2SO4+ S↓+ ( )。
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 。
高二化学填空题困难题查看答案及解析
-
(10分)许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同条件下发生的还原反应如下:
①酸性:MnO4-+5e-+8H+→Mn2++4H2O;
②中性:MnO4-+3e-+2H2O→MnO2+4OH-
③碱性:MnO4-+e-→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e-→Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是___________________________________。
(2)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是_______。(选填编号)
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(3)写出将SO2通入KMnO4溶液中所发生反应的离子方程式,并配平:
________________________________________________________________________。
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,已知产物中K2SO4和S的物质的量之比为3∶2。完成并配平该反应的化学方程式:
□KMnO4+□K2S+□__________→□K2MnO4+□K2SO4+□S↓+□__________,反应若生成5.44 g硫单质,反应过程中转移电子的物质的量为__________________。
高二化学填空题困难题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别
10%硫酸体积/mL
温度/℃
其他物质
A
2mL
20
B
2mL
20
10滴饱和MnSO4溶液
C
2mL
30
D
1mL
20
V1 mL蒸馏水
E
0.5mL
20
V2 mL蒸馏水
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
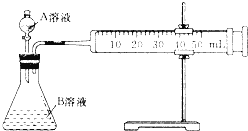
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.
高二化学简答题中等难度题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别
10%硫酸体积/mL
温度/℃
其他物质
A
2mL
20
B
2mL
20
10滴饱和MnSO4溶液
C
2mL
30
D
1mL
20
V1 mL蒸馏水
E
0.5mL
20
V2 mL蒸馏水
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
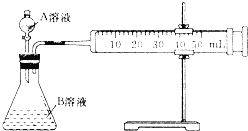
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.
高二化学综合题中等难度题查看答案及解析
-
(10分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2+ + CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别
10%硫酸体积/mL
温度/℃
其他物质
I
2 mL
20
II
2 mL
20
10滴饱和MnSO4溶液
III
2 mL
30
IV
1 mL
20
1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
高二化学实验题中等难度题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H 2C2O4+H+--Mn2++CO2↑+H2O(未配平) 用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H 2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验________ 和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________.组别 10%硫酸体积/mL 温度/℃ 其他物质 Ⅰ 2mL 20 Ⅱ 2mL 20 10滴饱和MnSO4溶液 Ⅲ 2mL 30 Ⅳ 1mL 20 1mL蒸馏水
(2)对比实验Ⅰ和Ⅳ,可以研究________对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是________.高二化学填空题中等难度题查看答案及解析
-
草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
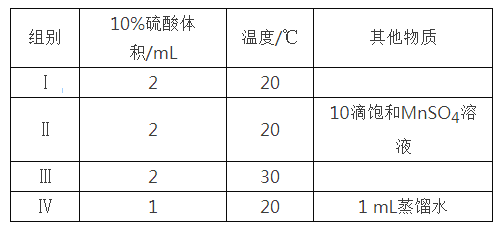
(1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。高二化学实验题中等难度题查看答案及解析
-
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
高二化学填空题中等难度题查看答案及解析
-
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:
(已知:MnO4-在酸性环境下的还原产物是Mn2+ )
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4·2H2O) g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和 .
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如下表所示:
试管1
试管2
实验现象
褪色很快
褪色很慢
褪色时间/s
4秒
31秒
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是: .
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为: .
③同学测出的颜色变化的时间是以下列哪个选项为依据的 .
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫 红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是 .
于是甲同学得出结论 .
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率 因素的另外两种可能原因,你认为他们提出的两种可能原因是:
I II
高二化学实验题困难题查看答案及解析