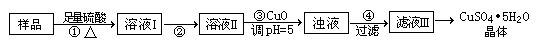-
(12分)CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为________,发生反应的离子方程式为________。
(2)实际制得的胆矾晶体中还是含有一些杂质,通常采用________法提纯。
(3)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
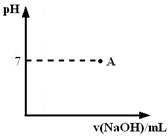 ________。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
________。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是________。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
-
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.

根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 .
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是 .
(3)已知:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
称取0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液啊28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4•5H2O g.
(4)如果采用重量法测定CuSO4•5H2O的含量,完成下列步骤:
① ②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 .
-
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
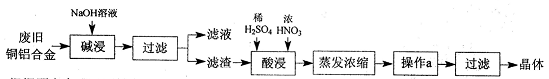
根据题意完成下列填空:
(1)“碱浸”的目的是________,写出有关的离子方程式________。
(2)向滤渣中先加入足量稀硫酸,然后再滴加少量浓硝酸,在废渣溶解时可以观察到的实验现象有。
(3)操作a的名称为________,制得的CuSO4·5H2O中可能存在硝酸铜杂质,除去这种杂质的实验操作名称为________。
(4)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4。称取0.26 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸8.00 mL,则该试样中CuSO4·5H2O的质量分数为________;上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用________。
(5)在“酸浸”的步骤中,①若只加入浓硫酸,写出加热时的化学方程式________。
②若将浓硝酸换成过氧化氢,常温时即可生成硫酸铜,指出此种方法的优点________。
-
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
-
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程图.

根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:______、______.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是______,除去这种杂质的实验操作称为______.
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4•5H2O______g.
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用______.在滴定中,准确读数应该是滴定管上蓝线______所对应的刻度.
(5)如果采用重量法测定CuSO4•5H2O的含量,完成下列步骤:①______②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)在过滤前,需要检验是否沉淀完全,其操作是______
(6)如果1.040g提纯后的试样中含CuSO4•5H2O的准确值为1.015g,而实验测定结果是l.000g 测定的相对误差为______.
-
(本题共12分)CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4∙5H2O的实验室制备流程圈。

根据题意完成下列填空:
41、向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),在铜粉溶解时可以观察到的实验现象: 。
42、根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 。
43、已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
称取0.1000g提纯后的CuSO4∙5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4∙5H2O g。
44、在滴定中,眼睛应注视 ;滴定终点时,准确读数应该是滴定管上蓝线所对应的刻度。
45、若上述滴定操作中,滴定管加盐酸之前未进行润洗,则测得试样中所含CuSO4∙5H2O的质量 (填“偏大”“偏小”或“无影响”)。
46、如果l.040g提纯后的试样中含CuSO4∙5H2O的准确值为1.015g,而实验测定结果是1.000g,测定的相对误差为 。
-
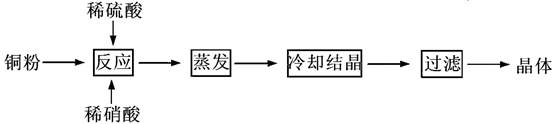
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
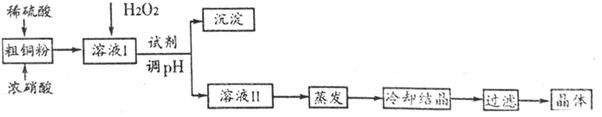
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
除去Fe3+,溶液的pH应控在_______________范围,调pH可选用的试剂是____________。
(3)若制得的CuSO4·5H2O中存在杂质Cu(NO3)2,进一步提纯的实验操作名称是__________。
(4)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是____________。
用标准的BaCl2溶液测定晶体的纯度时,发现纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_____________________________________________(任写一种)。
(5)实验室欲制取适量NO气体。下图中最适合的实验装置是__________(填序号),并注明装置中所需药品的名称。
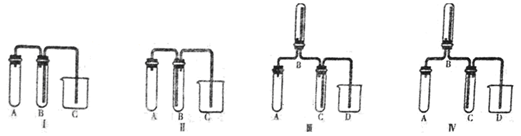
A.__________,B.__________,C.__________,D.__________。(根据选择的装置可以填满也可以不填满)
-
CuSO4 ∙ 5H2O是铜的重要化合物,有着广泛的应用。
(一)CuSO4·5H2O制取
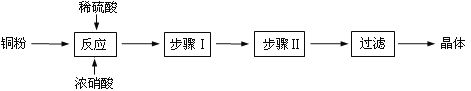
完成下列填空:
(1)向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象:_____。
(2)根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为______________________。
(3)步骤Ⅰ______________;步骤Ⅱ______________。
(二)胆矾中CuSO4·5H2O含量的测定
已知:CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
(1)实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④___________________________
⑤数据处理。
(2)在滴定中,眼睛应注视__________;滴定终点时,准确读数应该是滴定管上________所对应的刻度。
(3)就方案中数据进行处理,则样品CuSO4·5H2O中质量分数为___________。步骤③中沉淀未洗涤,导致结果______(填偏大、偏小、无影响)。
-
CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。CuSO4∙5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)
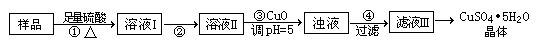
回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol∙L-1的稀硫酸,只需________种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是________
发生反应的离子方程式:________
⑶如何证明Fe2+已经充分转化?________
⑷步骤④之后的实验操作是________,所需仪器是铁架台(带铁圈)、
________及抽滤装置。
Ⅱ.实验室用铜粉制备的CuSO4∙5H2O流程图如下:
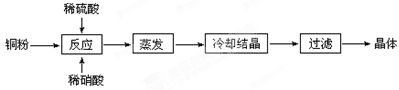
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为________,
发生反应的离子方程式为________。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用法提纯。
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是________
________。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
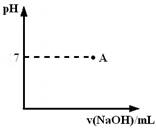
⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是________。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
-
(14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下:
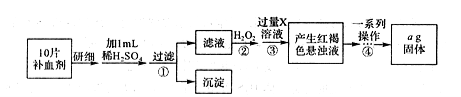
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。


 ________。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
________。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。