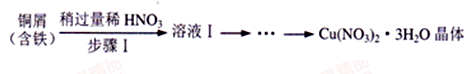-
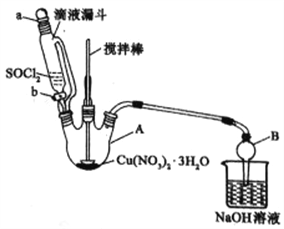
某同学在实验室以铜屑(含有少量CuO)为原料制备适量无水Cu(NO3)2工艺流程如图:

已知:①SOCl2熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体;
②4NH3·H2O+Cu2+=[Cu(NH3)4]2++4H2O;
[Cu(NH3)4]2+对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比。回答下列问题:
(1)从绿色化学、原子经济性角度考虑,试剂X为__。
(2)步骤II包括蒸发浓缩、冷却结晶等步骤,蒸发时所用容器名称是__,停止加热的时机是__。
(3)步骤III在如图1所示装置(夹持及控温装置省略)中进行。

①实验中,若仅打开装置活塞b的情况下,恒压滴液漏斗中液体__(填“能”或“不能”)全部流下。
②C中产生的现象是__。
③D的作用是__。
④写出A中三颈烧瓶内Cu(NO3)2·3H2O与SOCl2恰好反应生成Cu(NO3)2的化学方程式:__。
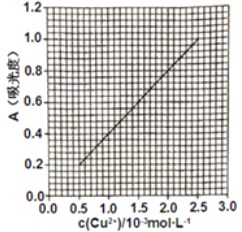
(4)用分光光度法可测定产品的纯度。现准确称取0.50g无水Cu(NO3)2产品,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.600。已知[Cu(NH3)4]2+的吸光度A与Cu2+标准溶液浓度关系如图2所示。
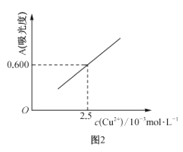
①量取10.00mLCu(NO3)2溶液所用量器名称是__。
②无水Cu(NO3)2的纯度是__(以质量分数表示)。
-
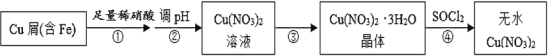
某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
已知:SOCl2 熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质______(填化学式),调 pH 后需进行的操作是_____。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至______。
(3)第④步中发生反应的化学方程式是______。
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由_______。
装置改进后,向仪器 A 中缓慢滴加 SOCl2 时,需打开活塞_____(填“a”“b”或“a 和 b”)。
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:_______。
(6)为测定无水Cu(NO3)2 产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_______(以质量分数表示)。
-
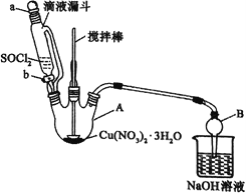
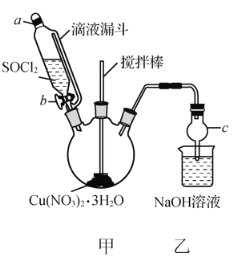
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 • 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。 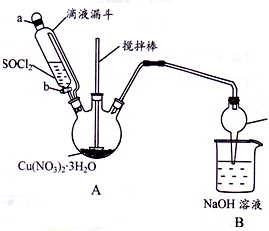 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 • 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 • 3H2O的实验方案如下:
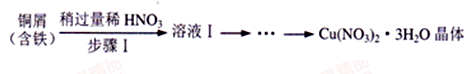
己知几种离子生成氢氧化物沉淀的pH如下表
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ • | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 • 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 • 3H2O晶体。
-
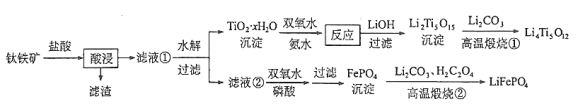
某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu (NO3)2·3H2O  Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2  CuO
CuO
SOCl2熔点 -105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。 请回答:
(1)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_______。
(2)第④步中发生反应的化学方程式是_____________。
(3)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图1有一处不合理,请提出改进方案并说明理由_______________。

(4)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图2所示:准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3 ·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
-
某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O  Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2  CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。
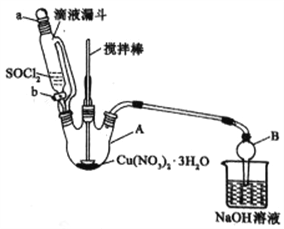
装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
-
某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O  Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2  CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。
装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
-
某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2.设计的合成路线如下:

已知:①Cu(NO3)2•3H2O Cu(NO3)2•Cu(OH)2
Cu(NO3)2•Cu(OH)2 CuO
CuO
②SOCl2熔点﹣105℃、沸点76℃、遇水剧烈水解生成两种酸性气体、水解强烈放热,
请回答:
(1)Cu与足量稀HNO3反应的化学方程式_____
(2)第②步调pH适合的物质是_____(填化学式).
(3)第③步包括蒸发浓缩、冷却结晶、过滤等步骤,其中蒸发浓缩的具体操作是_____.为得到较大颗粒的Cu(NO3)2•3H2O晶体,可采用的方法是_____(填一种).
(4)第④步中发生的反应化学方程式是_____.
(5)第④步,某同学设计的实验装置示意图(如图1)有一处不合理,请提出改进方案并说明理由:_____;装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞_____(填“a”、“b”或“a和b”).反应过程中,可能会因温度过高而有副反应,写出两种有效措施_____、_____.
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法.
已知:4NH3•H2O+Cu2+═Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比.现测得Cu(NH3)42+的吸光度A与Cu2+标准溶液浓度关系如图2所示:

准确称取0.315 0g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3•H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.600,则无水Cu(NO3)2产品的纯度是_____(以质量分数表示).
-
某研究小组由Cu(NO3)2溶液先制得Cu(NO3)2·3H2O晶体,然后在下图所示实验装置中(夹持及控温装置省略),用Cu(NO3)2·3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知:SOCl2的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体。
(1)由Cu(NO3)2溶液制得Cu(NO3)2·3H2O晶体的实验步骤包括蒸发浓缩、冷却结晶、抽滤等步骤。
①蒸发浓缩时当蒸发皿中出现______________________________(填现象)时,停止加热。
②为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是_______________(填一种)。
(2)①仪器c的名称是________。
②向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞________(填“a”或“b”或“a和b”)。
(3)装置甲中Cu(NO3)2·3H2O和SOCl2发生反应的化学方程式为__________________________________。
(4)装置乙的作用是______________________________________。
-
已知甲酸铜是一种重要的化工原料,常温常压下稳定,可溶于水,难溶于乙醇,具有还原性,实验室可用废铜屑(主要成份是Cu、CuO,含有少量的Fe、Fe2O3) 制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
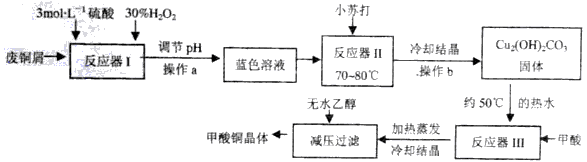
已知:

回答下列问题:
(1)反应器I中加入H2O2的作用是___________(用化学方程式表示)。
(2)反应器I之后溶液需调节pH的范围是___________;
(3)写出反应器II的离子方程式____________;反应器II中各反应物也可用相应物质的晶体经研磨后投入反应。则研磨时应该将固体原料放在___________(填仪器名称)中。
(4)反应器III中的反应及之后的操作应尽可能在充氮气的操作室内完成,原因是___________ 。
(5)甲酸铜晶体的纯度测定,实验方案:
a.准确称取mg甲酸铜晶体样品,配成250mL溶液;
b.用移液份移取25.00mL溶液于锥形瓶,加入20m11.0 mol/ LKOH溶液,充分反应后,静置数分钟。然后于锥形瓶中滴几滴酚酞试剂,用0.1000mol/ L硫酸标准溶液滴定至终点,消耗H2SO4标准溶液V1mL;
c.空白实验:重复上述步骤,只是不加入甲酸铜溶液,消耗H2SO4标准溶液V2mL;
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和________;
②甲酸铜晶体的纯度________(列表达式即可)
-
Cu2O是一种用途广泛的无机化工原料,一种以氧化铜矿(CuO,含有Fe2O3、Al2O3、SiO2杂质)为原料制备Cu2O的流程如图所示:

已知氨浸过程中仅发生的反应为:CuO+4NH3·H2O= [Cu(NH3)4]2++2OH-+3H2O
回答下列问题:
(1)氨浸之前需将矿物粉碎、过筛,目的是_______________________________。
(2)氨浸时的温度一般不超过30℃,主要原因是__________________。按此工艺,能否用NaOH溶液代替氨水?__________________(填“能”或“否”)。
(3)蒸馏过程中会生成一种黑色固体,则此过程中发生反应的化学方程式为____________。
(4)电解过程中阳极的电极反应式为_________________。
(5)Cu(OH)2也可与NH3·H2O反应,已知常温下:
Cu(OH)2(s)+4NH3·H2O(aq) [Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
[Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
Cu2+(aq)+4NH3·H2O(aq) [Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
[Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
则常温下Ksp[Cu(OH)2]=________________。
(6)为了尽量减少流程中所用原料的种类,还原过程可用气体A代替气体B,在加热条件下生成两种单质,该反应的化学方程式为________________________。






 .
.