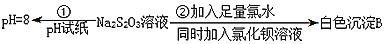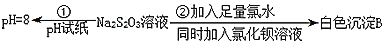-
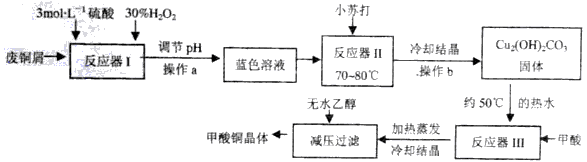
已知甲酸铜是一种重要的化工原料,常温常压下稳定,可溶于水,难溶于乙醇,具有还原性,实验室可用废铜屑(主要成份是Cu、CuO,含有少量的Fe、Fe2O3) 制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
已知:

回答下列问题:
(1)反应器I中加入H2O2的作用是___________(用化学方程式表示)。
(2)反应器I之后溶液需调节pH的范围是___________;
(3)写出反应器II的离子方程式____________;反应器II中各反应物也可用相应物质的晶体经研磨后投入反应。则研磨时应该将固体原料放在___________(填仪器名称)中。
(4)反应器III中的反应及之后的操作应尽可能在充氮气的操作室内完成,原因是___________ 。
(5)甲酸铜晶体的纯度测定,实验方案:
a.准确称取mg甲酸铜晶体样品,配成250mL溶液;
b.用移液份移取25.00mL溶液于锥形瓶,加入20m11.0 mol/ LKOH溶液,充分反应后,静置数分钟。然后于锥形瓶中滴几滴酚酞试剂,用0.1000mol/ L硫酸标准溶液滴定至终点,消耗H2SO4标准溶液V1mL;
c.空白实验:重复上述步骤,只是不加入甲酸铜溶液,消耗H2SO4标准溶液V2mL;
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和________;
②甲酸铜晶体的纯度________(列表达式即可)
-
一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A. 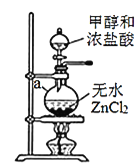 B.
B.  C.
C.  D.
D. 
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________。
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A________
②装置中水的主要作用是__________。
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为_____。
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
①滴定终点的现象为____________
②该反应甲醇的转化率为________。(用含有V、c的式子表示)
-
保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠( HCOONa) 法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸 B.浓硝酸
C.质量分数为70%的硫酸 D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示
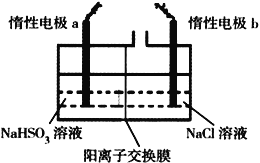
(7) ①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
-
硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O3•5H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O3•5H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O3•5H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O3•5H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
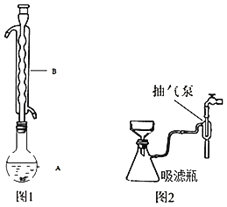
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
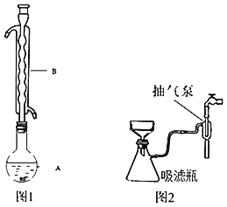
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
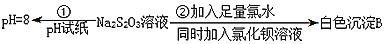
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
-
硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O3•5H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O3•5H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O3•5H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O3•5H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
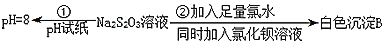
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
-
纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:

(1)“溶解”过程需要的玻璃仪器有 ;“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 ;为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;该制法的副产品为 (填化学式);若称取11.1g无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“偏高”、“偏低”、“无影响”、“不能确定”)
-
连二亚硫酸钠 又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
i.连二亚硫酸钠 是一种白色粉末,易溶于水,难溶于乙醇。
是一种白色粉末,易溶于水,难溶于乙醇。
ii.
iii.
II.制备方法
 ℃时将甲酸钠和纯碱加入乙醇水溶液中,通入
℃时将甲酸钠和纯碱加入乙醇水溶液中,通入 进行反应,完成其反应方程式:_____
进行反应,完成其反应方程式:_____ ______
______  ______ = ______
______ = ______  ______
______  ____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得
____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得 ;
;
III. 的性质
的性质
(1) 溶液在空气中易被氧化,课题小组测定
溶液在空气中易被氧化,课题小组测定

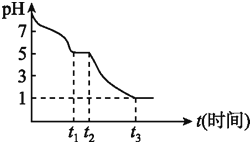
 溶液在空气中pH变化如图:
溶液在空气中pH变化如图: 段主要生成
段主要生成 ,根据pH变化图,
,根据pH变化图, 的电离平衡 ______ 水解平衡
的电离平衡 ______ 水解平衡 填“
填“ ”或“
”或“ ”
” ,课题小组推测
,课题小组推测 溶液在空气中易被氧化,
溶液在空气中易被氧化, 发生离子反应方程式为 ______
发生离子反应方程式为 ______  时溶液中主要阴离子符号是 ______ 。
时溶液中主要阴离子符号是 ______ 。
(2)隔绝空气加热 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和气体为 ______
和气体为 ______  填化学式
填化学式 请你设计实验验证产物有
请你设计实验验证产物有 存在,完成下表中内容.
存在,完成下表中内容. 供选择的试剂:稀盐酸、稀硝酸、
供选择的试剂:稀盐酸、稀硝酸、 溶液、
溶液、 溶液
溶液
| 实验步骤 不要求写出具体操作过程 不要求写出具体操作过程 | 预期的实验现象和结论 |
| ________ | ________ |
-
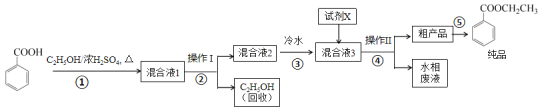
苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
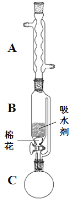
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
-
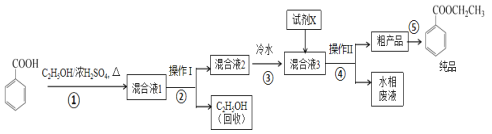
苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如图:
试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为__。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2h。仪器A的作用是__。
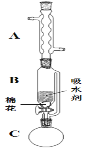
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为__。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_;操作II所用的玻璃仪器除了烧杯外还有__。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有__;加入试剂X为___(填写化学式)。
(6)最终得到产物纯品10.0g,实验产率为__%(保留三位有效数字)。
-
氯化铜、氯化亚铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜。已知:氯化铜容易潮解。氯化亚铜微溶于水,不溶于稀盐酸和酒精。
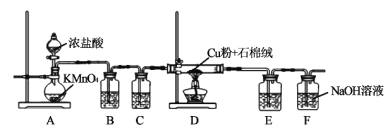
(1)装置A中发生反应的化学方程式为___。
(2)B装置的作用是___;C装置中的试剂是___;E装置的作用是___;F装置中可能发生的化学反应的离子方程式为___。
(3)当Cl2排尽空气后,加热D。装置D中的现象是___。
(4)另取CuCl2固体用于制备CuCl。将CuCl2固体溶解在适量蒸馏水中,并加入少量稀盐酸,然后向溶液中通入SO2气体并加热可得到CuCl白色沉淀,过滤、洗涤、干燥,即得CuCl晶体。
①制备CuCl反应的离子方程式为___;
②洗涤时,先用稀盐酸洗涤数次,后用酒精漂洗,用酒精漂洗的目的是___。


 B.
B.  C.
C.  D.
D.