-
氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:____________。
(2)与N3-互为等电子体的分子有:______(写一种)由此可推知N3-的空间构型是:_________; 比较NH2-和NH3的键角∠HNH的大小:NH2- ____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释_______。
(3)叠氮化钠(NaN3)分解可得纯N2,有关说法正确的是:________(选填代号)
A.氮气常温下很稳定,是因为氮元素的电负性大
B.NaN3与KN3结构类似,前者晶格能较小
C.第一电离能(I1):N>P>S
D.热稳定性NH3强于PH3和H2S是因为NH3分子间有氢键
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 ;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如下图所示):
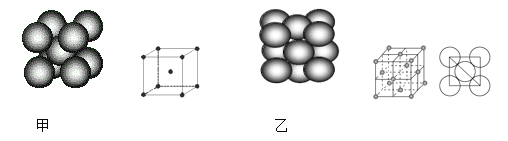
晶胞甲中铁原子的配位数为:_______,晶胞乙中铁原子的堆积方式为:________。晶胞乙中铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为M g/mol。则该晶体的密度可表示为:___________ g/cm3。
-
氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:____________。
(2)与N3-互为等电子体的分子有:______(写一种)由此可推知N3-的空间构型是:_________; 比较NH2-和NH3的键角∠HNH的大小:NH2- ____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释_______。
(3)叠氮化钠(NaN3)分解可得纯N2,有关说法正确的是:________(选填代号)
A.氮气常温下很稳定,是因为氮元素的电负性大
B.NaN3与KN3结构类似,前者晶格能较小
C.第一电离能(I1):N>P>S
D.热稳定性NH3强于PH3和H2S是因为NH3分子间有氢键
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 ;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如下图所示):
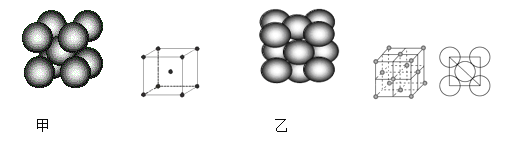
晶胞甲中铁原子的配位数为:_______,晶胞乙中铁原子的堆积方式为:________。晶胞乙中铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为M g/mol。则该晶体的密度可表示为:___________ g/cm3。
-
(共13分)叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph-代表苯基 )
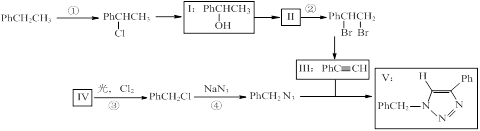
(1)下列说法不正确的是________(填字母)。
A.反应①、④属于取代反应
B.化合物I可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物I
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)
(3)反应③的化学方程式为________(要求写出反应条件)
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体。该同分异构体的分子式为________
, 结构简式为________。
(5)科学家曾预言可合成C(N3)4。其可分解成单质,用作炸药。有人通过NaN3与NC-CCl3反应成功合成了该物质。下列说法正确的是________(填字母)
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物III发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4→C+6N2↑
-
(7分)叠氮化合物应用广泛,如NaN3,可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件Ph—代表 苯基)
苯基)

(1) 下列说法不正确的是________(填字母,1分)
A. 反应①、④属于取代反应
B. 化合物I可发生消去反应,但不能发生氧化反应
C. 一定条件下化合物Ⅱ能生成化合物I
D. 一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2) 化合物Ⅱ发生聚合反应的化学方程式为(不要求写出反应条件)
________(2分)
(3) 化合物Ⅲ与PhCH2N3发生环加成反应成化合物V,不同条件下环加成反应还可生成化合物
V的同分异构体。该异构体的结构式为________。(2分)
(4) 科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与N C-CCl3,反应成功合成了该物质。下列说法正确的是________(填字母,2分.)。
C-CCl3,反应成功合成了该物质。下列说法正确的是________(填字母,2分.)。
A. 该合成反应可能是取代反应
B. C (N3)4与甲烷具有类似的空间结构
C. C(N3)4不可能与化合物Ⅲ发生环加成反应
D. C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4 C+6N2↑
C+6N2↑
-
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图_____________________。
②氮所在的周期中,第一电离能最大的元素为_____________(填元素符号)。
③与N3互为等电子体的粒子为____________(写出一种)。
④氨气的电子式____________。
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是____________
(3)依据价层电子对互斥理论,NO3-间构型呈__________形。
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是_________。
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为___________。(写成小数,保留2位有效数字)

-
叠氮化钠(NaN3)是一种无色结晶,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O=NaN3+NaOH+NH3、3NaNH2+NaNO3=NaN3+3NaOH+NH3↑
(1)下列说法正确的是 ________ .
A. N3-与N2O互为等电子体
B. NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C. NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因: ________
(3)依据价层电子对互斥理论,NO3-空间构型呈 ________形。
-
叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
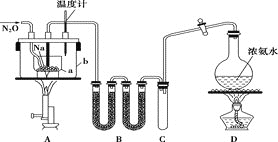
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为___;装置C的主要作用是___。
(2)步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为___。步骤③中最适宜的加热方式为____(填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是(填序号)___。
(4)生成NaN3的化学方程式为____。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是____。
(6)步骤④中用乙醚洗涤的主要目的是____。
-
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
-
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3 、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,NaN3中N3-中心原子采用 杂化。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
-
(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。







