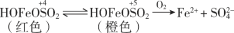-
某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
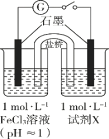
| 装置 | 编号 | 试剂X | 实验现象 |
| 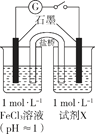
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________。
①取少量Na2SO3溶液电极附近的混合液,加入______________,产生白色沉淀,证明产生了 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________。
(3)实验I中负极的电极反应式为______________。
(乙同学的实验)
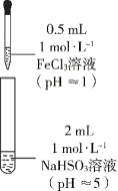
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
| 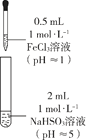
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 |
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3
 Fe(OH)3 +3SO2;②______________。
Fe(OH)3 +3SO2;②______________。
(5)查阅资料:溶液中Fe3+、 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
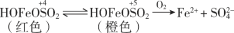
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________。
(实验反思)
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________。
-
某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
| 装置 | 编号 | 试剂X | 实验现象 |
| 
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)怎样配制FeCl3溶液? ________________________________________________________。
(2)甲同学探究实验I的电极产物。
① 取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
② 该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
| 
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 |
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3- Fe(OH)3 +3SO2;②_____________________________________________。
Fe(OH)3 +3SO2;②_____________________________________________。
(5)查阅资料:溶液中Fe3+、SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________________________。
(实验反思)
(6)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和______________________有关(写出两条)。
-
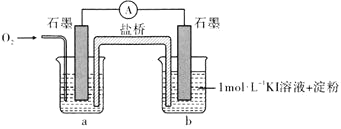
实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
| 实验 | 装置 | 试剂x | 操作及现象 |
| Ⅰ | 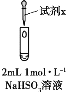
| 1 mol·L−1 CuCl2溶液 | 加入2mL CuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ | 1 mol·L−1 CuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
已知:Ⅰ.Cu2+ [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
Ⅱ. Cu+ [Cu(NH3)]+(无色溶液)
[Cu(NH3)]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验Ⅰ产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_______,反应的离子方程式为_______。
(2)对实验 Ⅰ 产生SO2的原因进行分析,提出假设:
假设a: Cu2+水解使溶液中c(H+)增大;
假设b: Cl-存在时,Cu2+与HSO3-反应生成CuCl白色沉淀,溶液中c(H+)增大。
① 假设a不合理,实验证据是_______;
② 实验表明假设b合理,实验I反应的离子方程式有_____、H+ + HSO3- = SO2↑+H2O。
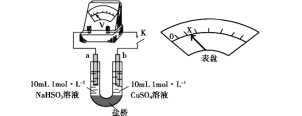
(3)对比实验Ⅰ、Ⅱ,提出假设:Cl-增强了Cu2+的氧化性。
下述实验Ⅲ证实了假设合理,装置如图。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_______(补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO32−。
①通过实验Ⅳ证实红色沉淀中含有Cu+和Cu2+。
实验Ⅳ: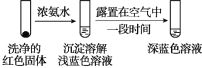
证实红色沉淀中含有Cu+的实验证据是_______;
②有同学认为实验Ⅳ不足以证实红色沉淀中含有Cu2+,设计实验Ⅳ的对比实验Ⅴ,证实了Cu2+的存在。实验Ⅴ的方案和现象是:_______。
-
某化学小组进行Na2SO3 的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
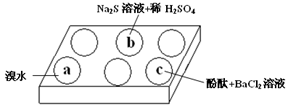
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有________性。
② b中发生反应的离子方程式是。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述)________。
(2)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO3 2—): n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
① 当吸收液中n(SO32-):n(HSO3-) =10:1 时,溶液中离子浓度关系正确的是________(填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
② 若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 ________ L。
-
某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
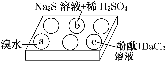
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)__________________________________________________________。
-
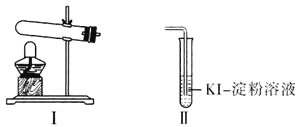
某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
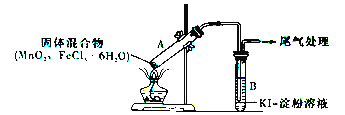
实验操作和现象如下表所示:
| 实验编号 | 操作 | 现象 |
| 实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。
-
资料显示“ 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。
供选试剂: 溶液、
溶液、 固体、
固体、 固体。
固体。
该小组同学设计 、
、 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 固体,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 
| 向Ⅰ试管中加入  固体, 固体, Ⅱ试管中加入适量  溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 溶液,连接装置Ⅰ、Ⅱ,点燃酒精灯 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用 固体制取
固体制取 ,为避免
,为避免 固体随
固体随 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________, 组实验中
组实验中 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比 、
、 两组实验可知,
两组实验可知, 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 溶液略变蓝 |
| 
| 向Ⅰ试管中加入  固体,Ⅱ试管中滴加 KOH 溶液控制 固体,Ⅱ试管中滴加 KOH 溶液控制  , 连接装置Ⅰ、Ⅱ,点燃酒精灯 , 连接装置Ⅰ、Ⅱ,点燃酒精灯 | 无明显变化 |
对于实验 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“ 时
时 不能氧化
不能氧化 ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入 后________。
后________。
(iii)小刚同学向 的KOH溶液
的KOH溶液 含淀粉
含淀粉 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有 ,褪色的原因是________
,褪色的原因是________ 用离子方程式表示
用离子方程式表示 。
。
(4)该小组同学对实验过程进行了反思:实验 的现象产生的原因可能是________。
的现象产生的原因可能是________。
-
某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
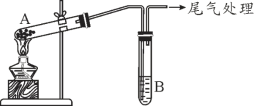
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
| 实验编号 | 操作 | 现象 |
| 实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
| 实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
-
某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。
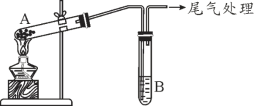
(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
| 实验编号 | 操作 | 现象 |
| 实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
| 实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
-
某学习小组通过下列装置探究 MnO2与FeCl3·6H2O能否反应产生Cl2。
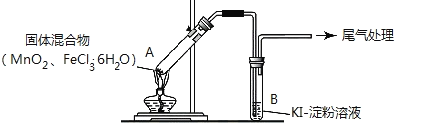
实验操作和现象如下表:
| 实验编号 | 操作 | 现象 |
| 实验 1 | 按上图所示加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
| 实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(1)实验1和实验2产生白雾的原因是___________________________。
(2)实验2说明黄色气体中含有___________(填化学式)则实验1中③的现象也可能是发生了另一个离子反应,则其离子方程式为______________________________。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B 间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是_________________;方案2中检验 Fe2+的试剂名称是____________,选择NaBr溶液的依据是__________________。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________。请你设计实验方案验证此猜想__________________________。
Fe(OH)3 +3SO2;②_____________________________________________。