-
为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入 3 mL 稀盐酸 ( 均足量 )(查阅资料获知,只有浓度小于 1 mol·L-1的稀盐酸跟 Na2CO3和 NaHCO3 反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈 ) ,将两个各装有 0.3gNaHCO3 和 Na2CO3粉末的小气球分别套在两支试管口上。将气球内的 NaHCO3 或 Na2CO3 同时倒入试管中,观察到现象如下:
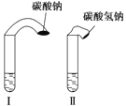
(1) 试管中产生的现象为_______________________________________;
(2)试管中气球大小 ( 包含试管 ) 体积之比约为 ( 填最简单整数比 )Ⅰ∶Ⅱ =________ ;
(3) 甲同学用手触摸试管,发现盛 NaHCO3粉末的试管变凉,而盛 Na 2 CO 3 粉末的试管温度有升高。由此他推测: NaHCO 3 溶液和稀盐酸反应为吸热反应,而 Na 2CO 3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确 ________( 填 “正确”或 “ 不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
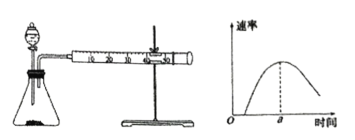
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
-
贞丰中学化学兴趣小组甲、乙、丙、三名同学探究化学反应速率的影响因素,实验如下。
(1)甲同学探究“温度对化学反应速率的影响”。取两支试管A、B,分别加入25mL 1mol/L 的HNO3溶液和0.5g相同的铜片,将A放在常温下,将B放在60摄氏度的水浴中。观察实验现象:铜片最先完全溶解的是 (填A或B)。据此得出结论 ,温度影响反应速率的本质原因 ,
(2)乙同学取两支试管C、D,各加入4mL0.01mol/LKMnO4酸性溶液,C中加入2mL0.1mol/LH2C2O4溶液,D中加入2mL0.2mol/LH2C2O4溶液,观察到的现象是 ,据此乙同学得出“反应物浓度越大,反应速率越快”的结论。写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 ,
(3)丙同学探究0.1mol/L FeCl3溶液对10%的H2O2溶液分解速率的影响,请你为她设计实验。
实验原理: (用化学方程式表示)。
实验操作: 。
-
(12分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
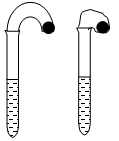
① 试管中(填产生沉淀或气体及反应速率等相关现象)____________________。
② 盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③ 甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL 稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《_____________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写):
a:NaHCO3的溶解是_______过程;
b:Na2CO3的溶解是_______过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。
-
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因
素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并
用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是_______。
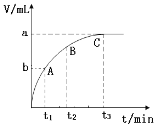
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
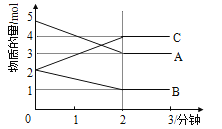
(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为________。
-
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与___________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
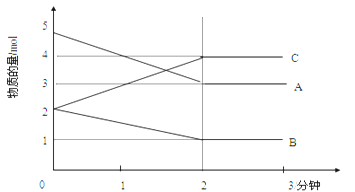
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是____。
A.降低温度 B.加入催化剂(正) C.增大容器体积
Ⅲ.为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________ 。
-
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________ 有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
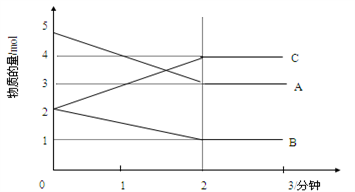
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度 B.加入催化剂(正) C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________ 。
-
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。

(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
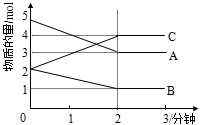
(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
-
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):

实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
-
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案。装置如图(夹持仪器略)实验方案:在两试管中分别加入过量形状大小相同的光亮镁条,将两注射器中的溶液同时注入相应试管中,观察产生氢气的速率和体积。
(1)醋酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是v(盐酸)_________v(醋酸)(填“<”、“>”或“=”);最终产生氢气体积的关系应是V(盐酸)_________V(醋酸)(填“<”、 “>”或“=”)。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是___________________________。
(6)下列事实不能说明醋酸是弱酸的是___________。
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH值约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水少
-
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案,装置如图:
实验方案:
在两试管中分别加入等大的过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)根据控制变量的思想,在上述实验方案中有一明显欠缺,该欠缺是 。
(2)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是盐酸 醋酸最终产生氢气的体积关系应是盐酸 醋酸。(填“大于”、“小于”或“等于”)
(3)实验中产生的氢气体积比理论值高,可能原因是 。实验室用过量镁与盐酸制取氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入___ ___
A. 冰醋酸 B. 醋酸钠固体 C. 石灰石 D . 水 E . 食盐溶液.
(4)该实验可以得出的结论是 ;除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中的一种方法 。











