-
氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
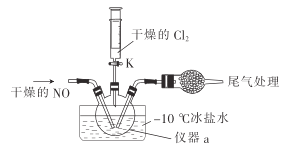
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
| 步骤 | 实验现象或反应的化学方程式 |
| ①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
| ②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
| ③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |
-
氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
| 步骤 | 实验现象或反应的化学方程式 |
| ①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
| ②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
| ③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |
-
亚硝酰氯( NOCl) 是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点- 64. 5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)方法一:将5 g 经300℃下干燥了 3h 并研细的 KCl 粉末装入 50 mL 带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0. 002 mol NO2。反应 12 ~ 36 min 即可完成,NO2红棕色消失 ,出现黄色亚硝酰氯,同时还得到一种盐。写出亚硝酰氯的电子式________,该方法制备NOCl的化学方程式为_________________,氯化钾需要“干燥”的原因是_______________。
(2)方法二:实验室可用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开 K2,然后再打开___________(填“K1 ”或"“K3 ”) 通入一段时间气体,其目的为______,然后进行其他操作,当 Z 有一定量液体生成时,停止实验。写出X 装置中反应的离子方程式_____________________ 。
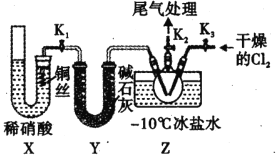
(3)测定产品纯度:取(2)中w g Z 中液态产品溶于蒸馏水,配制成250 ml 溶液;用酸式滴定管准确量取25. 00mL 所配溶液于锥形瓶中,滴加几滴 K2CrO4溶液作指示剂,用滴定管盛装 c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色固体,忽略杂质参与反应]
①盛装AgNO3 标准溶液的滴定管是____(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________________。
②该产品纯度为_____________(用代数式表示)。
-
亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是而机合成中的重要试剂。某同学用下图装置,由NO与干燥纯净的Cl2反应制备NOCl。
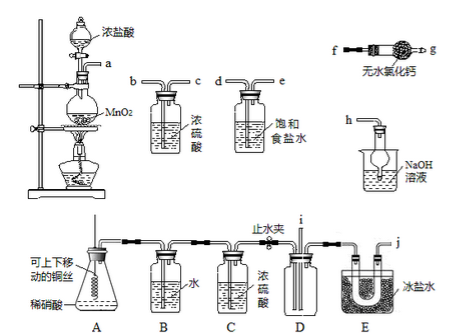
己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃
②2NO+Cl2= 2NOC1 2NO2 + Cl2=2NO2C1
2NO2 + Cl2=2NO2C1
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为_______________;装置A中设计了可上下移动的铜丝,其优点是_____________________。
(2)上图中实验装置的连接顺序为:a→__________________。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______________;
装置中充满氯气后,下—步是制取NO,具体操作是_______________;
E中冰盐水的温度可低至-22℃,其作用是_______________。
(4)该同学的实验设计可能的不足之处是__________________(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是_________(用化学方程式表示)。
-
亚硝酰氯 ,熔点:
,熔点: ,沸点:
,沸点: 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸 :
:
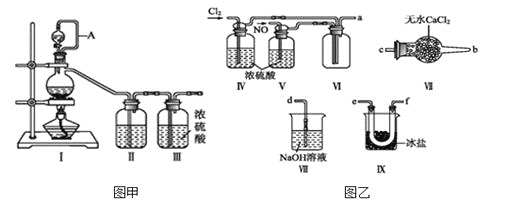
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净 | 
| 浓盐酸 |  _________________ _________________
|
| 制备纯净NO | Cu | 稀硝酸 |  _________________ _________________
|
(2)将制得的NO和 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
 装置连接顺序为
装置连接顺序为 ________
________ 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示 。
。
 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、 通入装置Ⅴ中,你同意此观点吗?_______
通入装置Ⅴ中,你同意此观点吗?_______ 填“同意”或“不同意”
填“同意”或“不同意” ,原因是___________。
,原因是___________。
 实验开始的时候,先通入氯气,再通入NO,原因为________________________。
实验开始的时候,先通入氯气,再通入NO,原因为________________________。
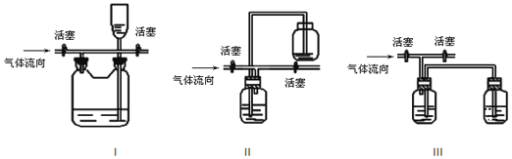
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取 样品溶于
样品溶于 溶液中,加入几滴
溶液中,加入几滴 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗 溶液
溶液 。则该样品的纯度为__________
。则该样品的纯度为__________ 保留1位小数
保留1位小数
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(其中III、IV中均为浓硫酸):
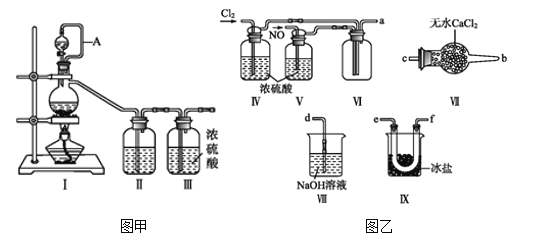
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
| 制备纯净NO | Cu | 稀硝酸 | ②___ |
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?________(填同意或不同意),原因是________________________________。
④实验开始的时候,先通入氯气,再通入NO,原因为________________。
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
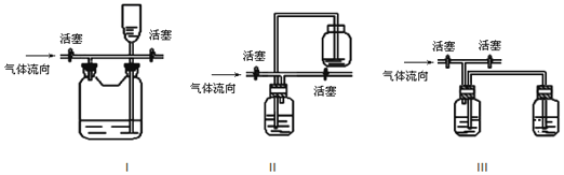
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6625 g样品溶于50.00 ml NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀,消耗AgNO3溶液50.00ml。
①样品的纯度为__________%(保留1位小数)
②已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12,若在滴定终点时测得溶液中Cr2O42-的浓度是5.0×10-3 mol/L,此时溶液中Cl-浓度是_________。
-
亚硝酰氯(ClNO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味、遇水反应生成一种氯化物和两种氮化物。某学习小组在实验空用Cl2和NO制备ClNO并测定其纯度,相关实验装置(夹持装置略去)如下图所示。请回答:
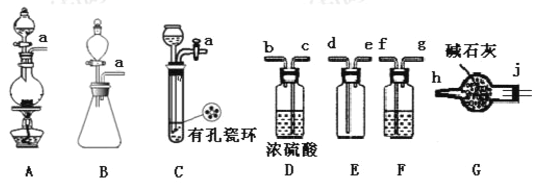
(1)制备C12发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式:____________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→_______(按气流方向,用小写字母表示)。
(3)实验室可用下图装置制备亚硝酰氯(C1NO):
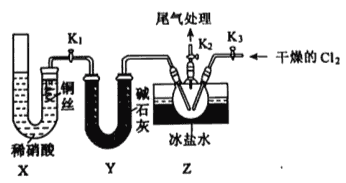
①实验室也可用B装置制备NO,X装置的优点为__________。
②检验装置气密性并装入药品,打开K2,然后再打开K1,通入一段时间气体,其目的为_______,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中C1NO可能发生反应的化学方程式为________。
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(C1NO)的质量分数为______(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(K2CrO4)=1×10-12]
-
亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点-64.5℃,沸点-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成,某化学兴趣小组设计如图装置制备NOC1。回答下列相关问题:
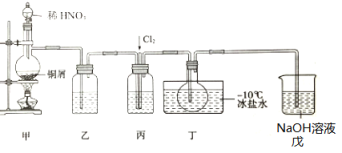
(1)NOCl分子中各原子均满足8电子稳定结构,NOCl的电子式为___。
(2)装置乙中的液体为___,装置丙作用是___。
(3)实验时,先通入Cl2,观察到丁中烧瓶内充满黄绿色气体时,再通入NO,这样操作目的是___。待丁中烧瓶内有一定量液体生成时,停止实验。
(4)上述装置设计有一不妥之处,理由是___(用化学方程式表示)。
(5)测定NOCl的纯度:取所得产物a g溶于水,配制成250mL溶液;取25.00mL于锥形瓶中,以K2Cr2O7溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为24.00mL。滴定终点的现象是___,亚硝酰氯(NOCl)的纯度为___。(Ag2CrO4砖红色:Ksp(AgCl)=1.56x10-10,Ksp(Ag2CrO4)=1.0x10-12,Ksp(AgNO2)=5.86×10-4)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
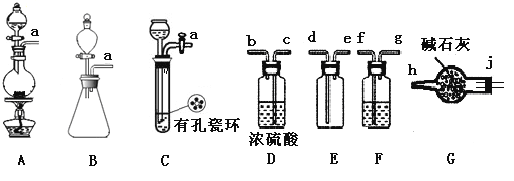
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
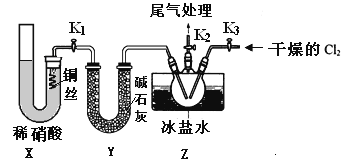
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
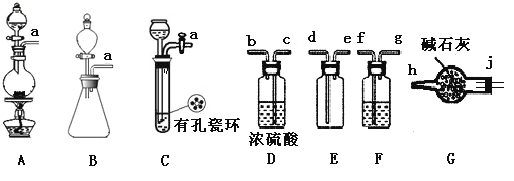
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
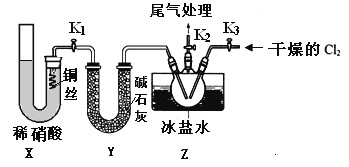
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。














