-
现有25℃时0.1mol•L-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中 __(填“增大”、“减小”或“不变”)。
__(填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol•L-1,则c(SO42-)=__。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___。
-
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应 的化学方程式为 ,平衡常数表达式为 。
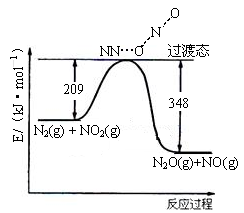
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。
-
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是________ 。
②纯碱溶液呈碱性的原因是(用离子方程式表示)________ 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式:________ 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为________ 。
-
(10分)现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 (增大、减小、不变)
(增大、减小、不变)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH 7(填“>”“<”或“=”)。
(3)若向该氨水中加入氢氧化钠固体,则该电离平衡向 方向移动(分子化、离子化),电离平衡常数 。(增大、减小或不变)
-
现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中氢氧根离子浓度________(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式________________;所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因______________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________;
-
(1)现有0.1mol•L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是______.纯碱溶液呈碱性的原因(用离子方程式表示)是______
-
(1)氨的水溶液显弱碱性,其原因为___________________(用离子方程式表示), 0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________;
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为___________________;
(3)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。已知Ksp(AgCl)=1.8×10-10,若向5mL0.018mol•L-1的AgNO3溶液中加入5mL0.020mol•L-1的盐酸,混合后溶液中的Ag+的浓度为______mol•L-1,pH为________。
-
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______。
(2)氯化铵水溶液显酸性,其原因为______(用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______(填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______;若有1mol硝酸铵完全分解,转移的电子数为______mol。
(4)3H2(g)+N2(g)⇌2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______。
-
(10分)现有常温下的0.1 mol/L纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):_____________________。
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
____________________________________________________________________。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%。请你设计实验证明该同学的观点是否正确_____________________________。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是 ________。
A.c(Na+)=2c(CO32-)
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1 mol/L
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
(4)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:________________________。
-
(8分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是
__________ _;____________
纯碱溶液呈碱性的原因是(用离子方程式表示)__________________________
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
_______________________ ___。____________________ ___。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是___ ___。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
__(填“增大”、“减小”或“不变”)。
