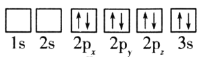-
金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:________________________。
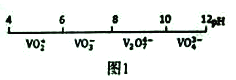
(2)“弱碱性铵盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、____________________________________。(请另写出一点原因)
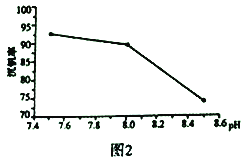
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)  2SO3(g) △H=p的催化剂,其催化原理如图3 所示。
2SO3(g) △H=p的催化剂,其催化原理如图3 所示。
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 请写出过程c 的热化学方程式:_________________。
②t2℃下,反应: 2SO3(g)  2SO2(g)+O2(g) △H>0;SO3的平衡转化率(a) 与体系总压强(p)的关系如图所示。
2SO2(g)+O2(g) △H>0;SO3的平衡转化率(a) 与体系总压强(p)的关系如图所示。
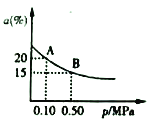
t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
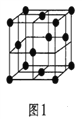
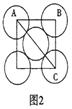
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
砷 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成 、
、 、
、 、
、 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣 主要成分为
主要成分为 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成 和单质硫
和单质硫 写出发生反应的化学方程式 _____________________________________________
写出发生反应的化学方程式 _____________________________________________  该反应需要在加压下进行,原因是 _______________________________________
该反应需要在加压下进行,原因是 _______________________________________
(3)已知: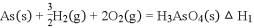

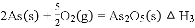
则反应 的
的 ________________________
________________________
(4) 时,将
时,将 、
、
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: 溶液中
溶液中 与反应时间
与反应时间 的关系如图所示.
的关系如图所示.
①下列可判断反应达到平衡的是 ______  填标号
填标号 .
.
 溶液的pH不再变化
溶液的pH不再变化 

 不再变化
不再变化 

② 时,
时, ______
______ 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③ 时,
时, ______
______ 时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是 ____________________
,理由是 ____________________
④若平衡时溶液的 ,则该反应的平衡常数K为 ______________
,则该反应的平衡常数K为 ______________
-
(16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式________
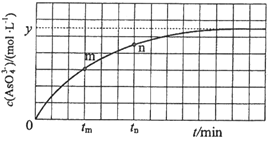
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是________
A MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B Mg与X2的反应是放热反应
C MgBr2与Cl2反应的△H<0
D 化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
① 该反应的离子方程式为________,平衡常数表达式为________
②在上述平衡体系中加入少量NaCl固体,平衡将________(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将________ ,氯气和水反应的平衡常数将________
________(填“变大”、“变小”、“不变”)。
③已知: H2CO3  HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
-
第IIA族元素在地壳内蕴藏较丰富,其单质和化合物用途广泛。回答下列问题:
(1)基态Ca原子M能层有_______个运动状态不同的电子,Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔沸点等都比金属Ca高,原因______。
(2)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是_________,中心原子的杂化方式为_______。
(3)碳酸盐的热分解示意图如下图所示。热分解温度:CaCO3__________(填“高于”或“低于”)SrCO3,原因是_______。从成键轨道看,CO2分子内的化学键类型有________。
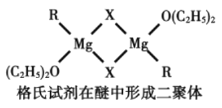
(4)格氏试剂RMgX是镁和卤代烃反应的产物,它在醚的稀溶液中以单体形式存在,在浓溶液中以二聚体存在,二聚体结构如下图所示。请在图中标出二聚体中的配位键__________。
-
铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:
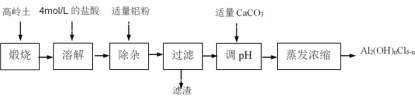
根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
-
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________,氧化性最弱的简单阳离子是(填离子符号)___________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
①工业制镁时,电解MgCl2而不电解MgO的原因是______________;
②制铝时,电解Al2O3而不电解AlCl3的原因是_________________;
③写出电解Al2O3反应方程式 。
-
铜及其化合物在生产生活中用途广泛。回答下列问题:
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是__(填序号)。
A.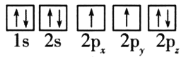 B.
B.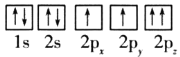
C.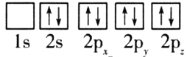 D.
D.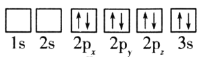
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。
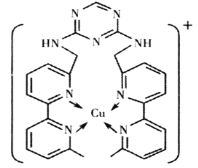
①该离子中含有化学键的类型有___(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
②H、N、Cu三种元素的电负性由大到小的顺序是___。H、N、Cu三种元素形成单质其熔点由低到高顺序为___。
(3)某磷青铜晶胞结构如图所示:

①其中原子坐标参数A为(0,0,0);B为(0, ,
, )。则P原子的坐标参数为___。
)。则P原子的坐标参数为___。
②该晶体中距离Cu原子最近的Sn原子有__个,这些Sn原子所呈现的构型为___。
-
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
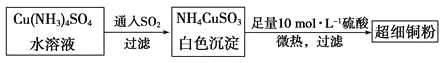
①Cu2+的价电子排布图________________; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②SO42-的空间构型为_____________,SO32-离子中心原子的杂化方式为__________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________.
-
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
Fe3+的外围电子排布式为 。
配合物Fe(CO)x 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x 晶体属于 (填晶体类型)。
Cu的晶胞如图所示,则晶体Cu的堆积方式为 。
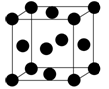
若Cu单质的晶体密度为ρ g/cm3,Cu的相对原子质量为M g/mol,阿伏加德罗常数为NA mol-1,则Cu的原子半径为 cm。
Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。


2SO3(g) △H=p的催化剂,其催化原理如图3 所示。
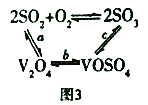
2SO2(g)+O2(g) △H>0;SO3的平衡转化率(a) 与体系总压强(p)的关系如图所示。



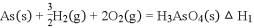
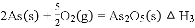
 溶液中
溶液中




 B.
B.
 D.
D.