-
(14分)某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数.查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.”为此,他们设计了如图所示的装置.
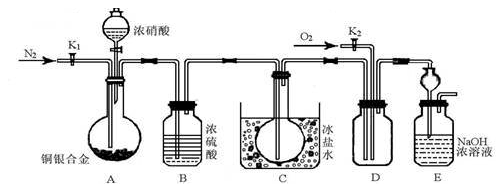
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方式 .
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 .
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2.
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 .
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5mol•L﹣1;实验后A溶液:V=40mL c(H+)=1.0mol•L﹣1.假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol.
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 .
-
(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:
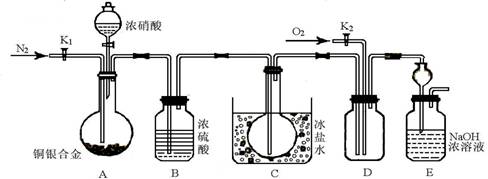
(1)写出A中Cu与HNO3反应可能的离子方程式。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是________;装置中B瓶的作用是________。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是________;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”)________的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为________mol________
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是________,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程)________。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是________。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
________。
-
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
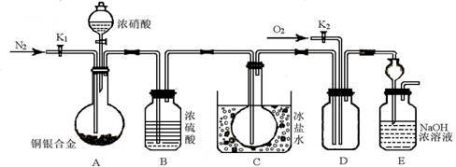
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为 mol。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
-
(14分)某研究性学习小组的同学利用下图来验证一定质量的铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数,已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。
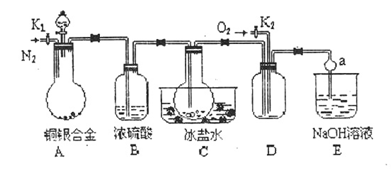
(1)写出A中铜与硝酸反应的一个化学方程式________;
(2)C装置的作用是________;
(3)反应结束后,打开活塞K2,并通入O2,若实验中有NO产生,则在D中可观察到的现象是________;
(4)反应前要先打开活塞K1持续通入一段时间的N2,其理由是________;
(5)利用A装置中反应后的溶液还可确定铜的质量分数,方法是:取出A中反应后的溶液,先向其中加入足量的________溶液,然后再进行________,________,________,________。(填操作名称)
-
某校研究性学习小组选择使用下列仪器和药品,验证铜和适量浓硝酸反应除生成NO2气体外,还生成少量的NO.(实验中使用的N2和O2的用量可自由控制).
已知:
①NO+NO2+2OH-=2NO2-+H2O
②气体液化温度 NO221℃NO-152℃
请回答:
(1)写出铜与浓硝酸反应的化学反应方程式______.
(2)装置B的作用是______,在上图方框内画出B装置.
(3)写出装置的连接顺序(填字母),A接B接______.
(4)实验开始前要先打开A装置中的活塞K1,持续通一段时间氮气后再关闭活塞K1,目的是______.A装置中的反应停止后,打开D中的活塞K2,并通入氧气,若反应中确有NO产生,则D中出现的现象是______.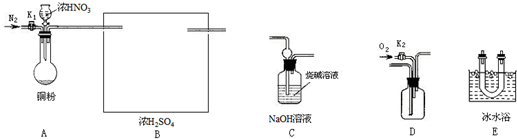
(5)如果O2过量,则装置C中发生反应的离子方程式是______.
(6)若铜粉中混入了少量银,已知铜粉质量为a g,反应后固体完全溶解,要测定铜粉中铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作,就可以达到实验目的.试简述实验方案______.
-
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:反应中除了生成NO2气体外还会有少量的NO生成;常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如下实验:

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置B瓶的作用是___。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___;实验发现,通入氧气温度的高低对实验现象有较大影响,则为便于观察应通入___(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___。
(5)实验测得下列数据:所用铜银合金质量:15.0g、浓硝酸:40mL13.5mol/L;实验后A中溶液体积:40mL;H+浓度:1.0mol/L。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为___。
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需要测定的数据是___。
(6)若实验只测定 Cu的质量分数,不验证NO的产生,则在铜银合金中与浓硝酸反应后,只需要简单的实验操作可达到目的,请简述实验过程:___。
-
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人没计如F实验装置:
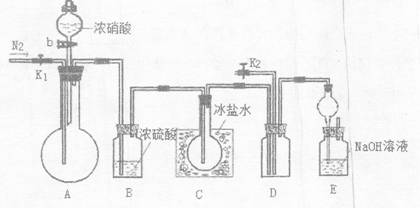
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________。
(2)装置中B瓶的作用是。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是________;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:____
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量________的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)
-
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
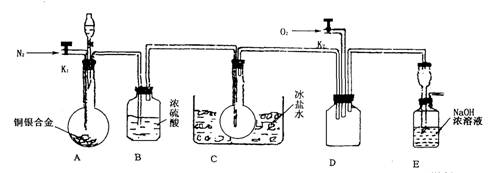
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是_____________________________________________________________。
(2)装置B瓶的作用是__________________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是__________________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程________________________。
-
(8分)某研究性学习小组,用下列仪器、药品验证足量合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(N2和O2的用量可自由控制,气体液化温度:
NO2:21℃,NO:-152℃)
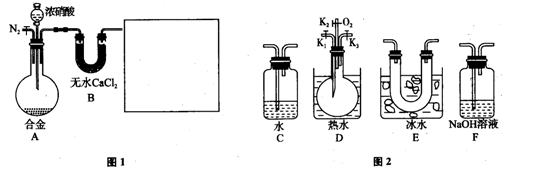
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为_________(2分).
(2)反应前先通入N2目的是_______________________________________(2分).
(3)确认气体中含NO的现象是_______________________________________(2分).
(4)本题中,浓硝酸(含溶质a mol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为_________________________________________(3分).
-
某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(:NO2 21℃;-NO-152℃)
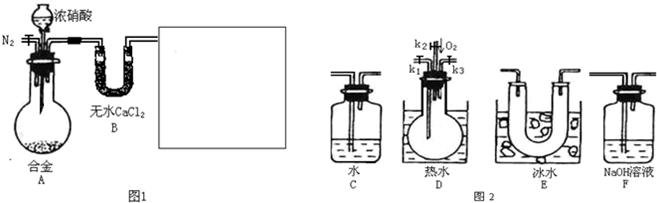
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为______
(2)反应前先通入N2目的是______
(3)确认气体中含NO的现象是______
(4)如果O2过量,则装置F中发生反应的化学方程式为:______
(5)反应结束后,关闭开关将烧瓶拿出后的现象为______给出合理的解释______
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为______.









