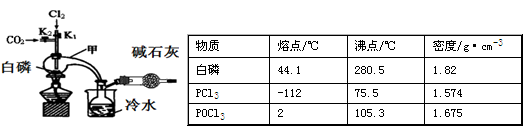-
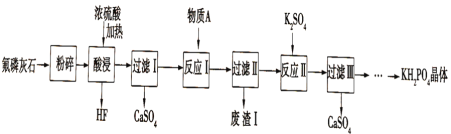
磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂;农业上常用作复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3还含有少量的Fe2O3、Al2O3等杂质]为原料制备KH2PO4晶体的一种流程如下:
回答下列问题:
(1)已知“酸浸”时的一个反应为Ca5F(PO4)3+ 5H2SO4(浓)= 5CaSO4+3H3PO4 + HF↑,该反应利用浓硫酸的_______(填“氧化性”“还原性”“强酸性”或“难挥发性" );“酸浸"过程所用的仪器不能采用二氧化硅陶瓷材料,其主要原因是(用化学方程式表示)__;
(2)已知物质A为CaCO3,则“废渣I”的主要成分为______;
(3)“反应II”的化学方程式为_____;
(4)将经过一系列除杂后得到的KH2PO4滤液加热浓缩,边加热边搅拌,待____时停止加热,冷却结晶,____、洗涤、干燥 ,得到KH2PO4晶体。
(5)常温下,H3PO4的电离平衡常数:Ka1=7.1 x10-3,Ka2 =6.3 x10-8 , Ka3=4.5x10-13。常温下,KH2PO4水溶液显酸性,请通过计算说明其原因_______;
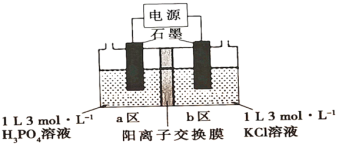
(6)用电解法制取KH2PO4的装置如图所示。该电解装置中,a区属于___(填“阳极"或“阴极")区,阳极区的电极反应式为__。
-
KH2PO4在农业上用作高效磷钾复合肥,在化学工业中还用作制偏磷酸钾的原料。一种电解法制备KH2PO4的装置如图所示。下列说法错误的是( )
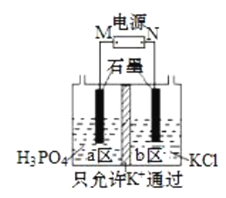
A.电源M极为负极,a区生成KH2PO4
B.b区电极反应为:4OH--4e-=O2↑+2H2O
C.电解过程中a区水的电离平衡正向移动
D.当0.1molK+通过离子交换膜时,阴阳两极产生的气体共2.24L(标准状况)
-
下列说法不正确的是
A. 氧化铝可以用作耐高温材料 B. 光导纤维的主要成分是单质硅
C. 工业上用氯气制造漂白粉 D. 钾钠合金可作快中子反应堆的热交换剂
-
次磷酸钠(NaH2PO2)常用作化学镀剂、食品及工业锅炉水添加剂、抗氧剂。实验室可用如图所示装置制取一定量的次磷酸钠。已知PH3是一种无色、有毒且能自燃的气体。
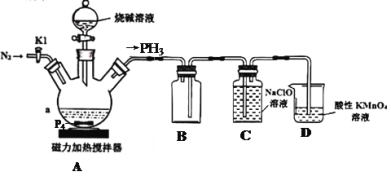
回答下列问题:
(1)装烧碱溶液的仪器名称是___,已知NaH2PO2与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是___元弱酸。
(2)实验开始时,首先要打开K1,通入一段时间N2,其目的是___,为尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是___,a中反应的化学方程式为___。
(3)装置C中物质反应后生成了NaCl、NaH2PO2,通过___的方法可分离出NaH2PO2固体(已知NaH2PO2在25℃时溶解度为100g,100℃时溶解度为667g)。
(4)产品纯度测定:取产品mg,将其溶于水配成250mL溶液,再用___(填“酸式”或“碱式”)滴定管取25.00mL溶液于锥形瓶中,然后用0.01mol·L-1的KMnO4标准溶液滴定(氧化产物是PO43-),达到滴定终点时消耗V1mLKMnO4标准溶液,滴定终点的现象是___,产品纯度为___。
-
三氯化磷( )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:
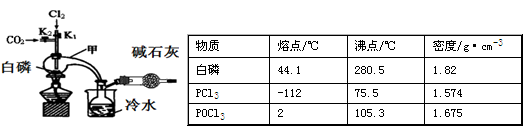
实验过程中要加入白磷、通入CO2 、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热。
(1)干燥管中碱石灰的作用是_______________。
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是____________________(己知亚磷酸H3PO3是二元弱酸:H3PO3  H++ H2PO3-,H2PO3-
H++ H2PO3-,H2PO3- H++HPO32-)。
H++HPO32-)。
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:

(1)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是_____________[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(2)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
己知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_____________(填字母序号),滴定终点的现象为_________________。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会______________(填“偏大”、“偏小”或“不变”)。
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为______________。
-
下列说法中,不正确的是
A.卤代烃一般易溶于水,常用作有机溶剂
B.苯酚是重要的有机化工原料,可用于制备酚醛树脂
C.乙二醇水溶液的凝固点低,可用作汽车发动机的抗冻剂
D.福尔马林具有防腐杀菌作用,能用于浸制生物标本
-
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中溶解度分别为:
NH4Cl:10℃时33.3g、20℃时37.2g、30℃时41.4g;
NaF:20℃时4g;Na2SiF6:微溶。
请回答下列问题:
(1)指出副产品的用途:________;(任填一种即可)
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒、漏斗外,还有___;
(3)操作II的名称是________;
(4)操作Ⅲ的具体过程是________ 、________;
(5)上述流程中发生两步化学反应,请分别写出其化学方程式:
第一步:________;
第二步:________;
(6)流程中NH4HCO3必须过量,其原因是________;
-
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 | | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
-
乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂。实验室通过乙醇脱水制备:
【原理】2CH3CH2OH CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
(170℃时产生CH2=CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
| 物质 | 熔点℃ | 沸点℃ | 溶解性 |
| 水 | 醇 | 醚 |
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
| | | | | |
【装置】
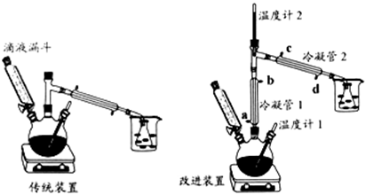
【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器。
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135—145℃.
III、反应停止后,去掉热源,得粗产品。
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤。
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚。
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加________ __,再加__________。
__,再加__________。
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是__________。
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对 高,水流方向为d→c→a→b
高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是( )
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是__________。
(5)在步骤IV中,仪器A的名称是__________。
(6)在步骤IV中,用NaOH溶液时为了除去__________,然后用试剂B洗涤 NaOH,以免跟CaCl2产生沉淀,试剂B最好是__________(“乙醇”、“蒸馏水”、“饱和NaCl溶液”)。
NaOH,以免跟CaCl2产生沉淀,试剂B最好是__________(“乙醇”、“蒸馏水”、“饱和NaCl溶液”)。
-
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室用CH3COOH (60g/mol)和CH3CH2CH2CH2OH(74g/mol)在浓硫酸加热条件下制备乙酸正丁酯(116g/mol)。
主要实验步骤如下:
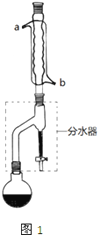
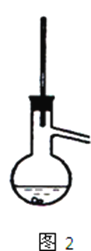
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.25g,0.125mol)正丁醇、7.2mL(12.0g,0.2mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层
②将酯层倒入小锥形瓶中,加少量无水硫酸镁
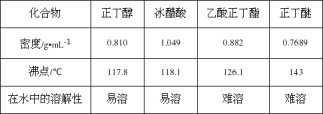
③过滤,将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:
根据以上信息回答下列问题:
(1)制备乙酸正丁酯的化学方程式为:__________________________________ ,制备过程中易生成副产物正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3),该副反应的化学方程式为:___________。
(2)图1整个装置可看作由分水器、圆底烧瓶和______(填仪器名称)组成,其中冷水应从______(填a或b)管口通入.分水器可将生成的水从反应体系中分离出来,有利于______,如何判断该合成反应达到了终点:_____________________。
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住旋塞将分液漏斗倒转过来,用力振荡,振摇几次后要放气,放气时支管口不能对着人和火.在操作步骤②加入无水硫酸镁的作用是________ 。
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在______中加热比较合适(双选)。
A.水 B.甘油(沸点290℃) C.砂子 D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有______杂质。
(5)反应结束后,生成11.6g乙酸正丁酯,则正丁醇的转化率约为______。