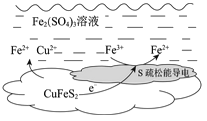
-
某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:
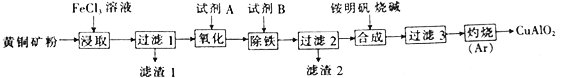
已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________(填代号)
| a | b | c | d |
| A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
| B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
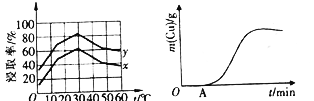
在20℃时,1L溶液中有效碰撞总次数:x_________y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________mol/L
-
黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2 Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
-
黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2 Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
-
黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。已知:2CuFeS2+4O2 Cu2S+3SO2+2FeO(Ⅰ)产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2
Cu2S+3SO2+2FeO(Ⅰ)产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2 2Cu2O+2SO2 (Ⅱ)2Cu2O+Cu2S
2Cu2O+2SO2 (Ⅱ)2Cu2O+Cu2S 6Cu +SO2↑ (Ⅲ)假定各步反应都完全。则下列说法正确的是
6Cu +SO2↑ (Ⅲ)假定各步反应都完全。则下列说法正确的是
A. 由6molCuFeS2生成6molCu消耗O2的物质的量为15mol
B. 6molCuFeS2和14.25molO2反应,理论上可得到铜的物质的量为3mol
C. 反应Ⅰ中CuFeS2仅作还原剂
D. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
-
有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
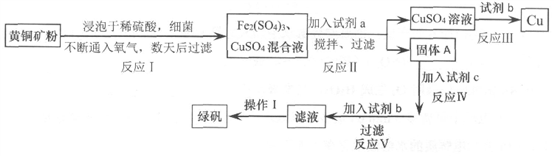
已知:
| Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
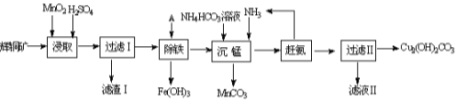
①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过__________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式__________________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是____________________ (写化学式)。
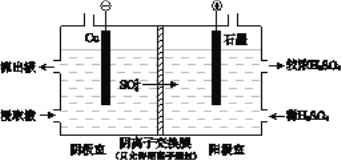
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了________mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总 质量相差__________g
质量相差__________g
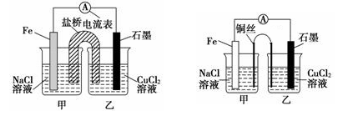
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
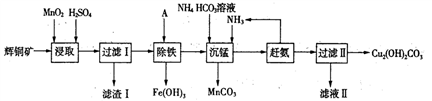
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
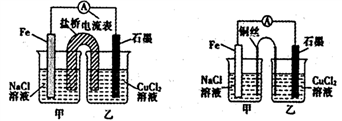
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
-
以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取铁的流程如图:
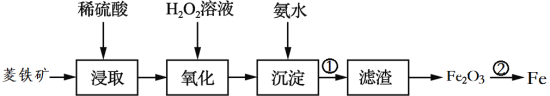
(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是__________(填“加快”或“减慢”)反应速率,写出浸取过程中的化学反应方程式:____________________________。
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为____________(填“蒸发”或“过滤”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于______(填“热还原法”或“电解法”)。
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________mol•L-1•min-1。
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3 ,用NH3表示该反应的速率v(NH3)=_____________mol•L-1•min-1。
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①;2Cu2O+Cu2S→6Cu+SO2…②.则
A.反应①中还原产物只有SO2
B.反应②中Cu2S只发生了氧化反应
C.将1 molCu2S冶炼成 2mol Cu,需要O21mol
D.若1molCu2S完全转化为2molCu,则转移电子数为2NA
-
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
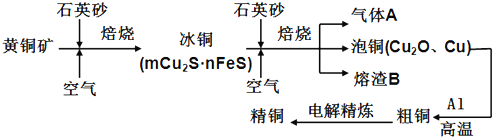
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为 g.
 Cu2++5Fe2++2S。
Cu2++5Fe2++2S。